Blog
QU’EST-CE QU’UN STÉRILISATEUR D’AIR : OBJECTIF, CHAMP D’APPLICATION, CARACTÉRISTIQUES DE CONCEPTION, TYPES
Dans le contexte sanitaire contemporain, la qualité de l’air intérieur des établissements de santé revêt une importance capitale pour la prévention des infections nosocomiales et la protection des patients les plus vulnérables. Les stérilisateurs d’air, dispositifs médicaux de haute technologie, constituent une réponse technologique avancée aux défis de la transmission aéroportée d’agents pathogènes, offrant une protection active et continue contre les contaminations microbiologiques.
Introduction
La distinction entre stérilisateur d’air et purificateur d’air constitue un enjeu technique et réglementaire fondamental dans le domaine médical. Contrairement aux purificateurs d’air destinés au grand public, qui se contentent de filtrer les particules et d’améliorer la qualité olfactive, les stérilisateurs d’air sont conçus pour éliminer ou inactiver activement les micro-organismes pathogènes présents dans l’air ambiant. Cette différenciation implique des exigences de performance, de validation et de traçabilité incomparablement plus strictes.
L’importance de la qualité de l’air dans les établissements de santé s’est imposée progressivement au cours des dernières décennies, sous l’impulsion de recherches épidémiologiques révélant l’ampleur de la transmission aéroportée. Les données de l’Organisation Mondiale de la Santé (OMS) indiquent que 15 à 20% des infections nosocomiales sont attribuables à des contaminations aéroportées, représentant 500 000 à 700 000 cas annuels en Europe, avec un coût économique estimé à 1,5 milliard d’euros.
Les statistiques récentes révèlent l’ampleur du défi : dans les hôpitaux européens, 8,9% des patients hospitalisés développent au moins une infection nosocomiale selon l’European Centre for Disease Prevention and Control (ECDC). Parmi ces infections, 35% impliquent une composante de transmission aéroportée, particulièrement préoccupante dans les services à risque élevé comme les unités de soins intensifs (21% d’infections), les services d’hématologie-oncologie (28%), et les blocs opératoires (12% d’infections du site opératoire).
La pandémie de COVID-19 a révolutionné la perception de la transmission aéroportée et accéléré l’adoption des technologies de stérilisation de l’air. Les recommandations sanitaires internationales, initialement centrées sur la transmission par gouttelettes, ont évolué vers la reconnaissance de la transmission par aérosols, imposant de nouveaux standards de protection. Cette évolution réglementaire a généré un marché global des stérilisateurs d’air médicaux estimé à 2,8 milliards de dollars en 2023, avec une croissance prévisionnelle de 12% annuels jusqu’en 2028.

Les enjeux sanitaires post-COVID-19 ont profondément modifié les exigences de qualité de l’air intérieur. Les nouvelles directives de l’OMS recommandent des taux de renouvellement d’air de 12 volumes/heure minimum dans les zones critiques, contre 6 volumes/heure précédemment. Cette évolution impose l’intégration de technologies de stérilisation active pour atteindre les performances requises sans compromettre l’efficacité énergétique des installations.
L’évolution réglementaire s’accompagne d’innovations technologiques majeures : développement des UV-C LED à efficacité renforcée, optimisation des systèmes photocatalytiques, perfectionnement de l’ionisation bipolaire contrôlée, et émergence du plasma froid atmosphérique. Ces technologies, validées par des protocoles de test rigoureux selon les normes ISO 14644 et NFS 90-351, offrent des solutions adaptées aux contraintes spécifiques de chaque environnement médical.
Cet article propose une analyse exhaustive des stérilisateurs d’air, structurée autour de quatre axes principaux : la définition des objectifs et principes fondamentaux, l’identification des champs d’application spécifiques, l’analyse des caractéristiques de conception, et la présentation détaillée des différents types technologiques disponibles. Cette approche systémique vise à fournir aux professionnels de santé, ingénieurs biomédicaux, et responsables techniques les informations nécessaires pour optimiser leurs choix technologiques et leurs stratégies d’investissement.
1. Objectifs et Principes Fondamentaux
1.1 Définition et Objectifs Principaux
Un stérilisateur d’air est un dispositif médical conçu pour éliminer, inactiver ou détruire les micro-organismes pathogènes présents dans l’air ambiant par des moyens physiques, chimiques ou photochimiques. Cette définition, établie par la norme internationale ISO 14937, distingue clairement ces équipements des simples purificateurs d’air par leur capacité d’inactivation microbienne validée et quantifiée. L’objectif primordial consiste à réduire la charge microbienne aéroportée à des niveaux compatibles avec les exigences de sécurité sanitaire spécifiques à chaque environnement.
L’élimination des agents pathogènes aéroportés constitue le cœur de mission des stérilisateurs d’air. Ces dispositifs ciblent prioritairement les micro-organismes de taille comprise entre 0,1 et 10 μm : virus enveloppés et non enveloppés (0,02-0,3 μm), bactéries végétatives (0,5-5 μm), spores bactériennes (0,8-2 μm), et champignons filamenteux (2-10 μm). L’efficacité d’élimination, exprimée en réduction logarithmique, doit atteindre minimum 3 log₁₀ (99,9%) pour les applications médicales standard, et 6 log₁₀ (99,9999%) pour les environnements critiques.
Agents pathogènes ciblés par stérilisation de l’air :
- Virus : Influenza A/B, SARS-CoV-2, Rhinovirus, Adénovirus (0,02-0,3 μm)
- Bactéries : Staphylococcus aureus, Pseudomonas aeruginosa, Mycobacterium tuberculosis (0,5-5 μm)
- Spores : Clostridium difficile, Bacillus anthracis, Aspergillus niger (0,8-2 μm)
- Champignons : Candida albicans, Aspergillus fumigatus, Penicillium (2-10 μm)
- Allergènes : Acariens, pollens, squames animales (5-50 μm)
La réduction de la transmission des infections nosocomiales représente l’objectif sanitaire majeur justifiant l’investissement dans ces technologies. Les études épidémiologiques démontrent qu’une amélioration de la qualité de l’air par stérilisation active peut réduire de 25 à 40% l’incidence des infections respiratoires nosocomiales, selon les données publiées par le New England Journal of Medicine. Cette réduction se traduit par des bénéfices cliniques (diminution morbidité/mortalité) et économiques (réduction durée séjour, coûts traitement) substantiels.
La protection des patients immunodéprimés constitue une indication spécifique particulièrement critique. Les patients en hématologie-oncologie, transplantation d’organes, ou immunosuppression thérapeutique présentent une susceptibilité accrue aux infections opportunistes aéroportées. Pour ces populations à risque, les stérilisateurs d’air offrent une protection environnementale indispensable, complémentaire aux mesures d’isolement et aux traitements prophylactiques. L’efficacité protective doit atteindre 99,99% (4 log₁₀) minimum selon les recommandations de la Société Française d’Hématologie.
La conformité aux réglementations sanitaires motive également l’adoption de ces technologies. Les référentiels internationaux (Joint Commission International, Haute Autorité de Santé) intègrent progressivement des exigences de qualité de l’air contraignantes. La norme française NFS 90-351, référence européenne du traitement d’air en établissement de santé, impose des niveaux d’empoussièrement et de contamination microbienne de plus en plus stricts, nécessitant souvent l’appoint de stérilisation active.
1.2 Différence Stérilisation vs Purification vs Désinfection
La stérilisation de l’air vise l’élimination complète de toute forme de vie microbienne, incluant les formes végétatives et sporulées les plus résistantes. Cette définition, alignée sur les standards de stérilisation des dispositifs médicaux, exige l’obtention d’un Niveau d’Assurance de Stérilité (SAL – Sterility Assurance Level) de 10⁻⁶, signifiant une probabilité de survie microbienne inférieure à 1 sur 1 million. Ce niveau de performance, techniquement complexe à atteindre pour l’air en flux continu, reste l’objectif de référence pour les environnements les plus critiques.
La désinfection de l’air, niveau intermédiaire de traitement, vise une réduction significative mais non absolue de la charge microbienne. L’efficacité requise correspond généralement à une réduction de 99,9% (3 log₁₀) des micro-organismes végétatifs et 99% (2 log₁₀) des formes sporulées. Cette approche, plus facilement réalisable techniquement, constitue le standard de la plupart des applications hospitalières courantes selon les recommandations du Centers for Disease Control and Prevention (CDC).
Traitement Réduction Microbienne SAL Équivalent Applications Typiques Technologies Stérilisation ≥ 6 log₁₀ (99,9999%) 10⁻⁶ Blocs opératoires, salles blanches A UV-C haute intensité, Plasma Désinfection 3-5 log₁₀ (99,9-99,999%) 10⁻³ à 10⁻⁵ Services soins, chambres patients UV-C standard, Photocatalyse Purification 1-2 log₁₀ (90-99%) Non applicable Espaces publics, bureaux HEPA, IonisationLa purification de l’air se concentre sur l’élimination physique des particules sans nécessairement inactiver les micro-organismes capturés. Les filtres HEPA (High Efficiency Particulate Air), référence de cette approche, retiennent 99,97% des particules de 0,3 μm par capture mécanique. Bien qu’efficaces pour réduire la charge particulaire, ces systèmes ne garantissent pas l’inactivation des pathogènes retenus, pouvant potentiellement constituer des réservoirs de contamination lors du remplacement des filtres.
1.3 Principes Physiques et Biologiques
La taille des micro-organismes conditionne directement l’efficacité des technologies de stérilisation. Les virus, plus petits agents pathogènes (20-300 nm), nécessitent des approches spécifiques : irradiation UV-C à haute dose, oxydation par radicaux libres, ou capture par filtration submicronique. Les bactéries végétatives (0,5-5 μm) présentent une sensibilité intermédiaire aux traitements physico-chimiques, tandis que les spores bactériennes (0,8-2 μm) exigent des conditions d’inactivation extrêmes du fait de leur résistance exceptionnelle.
Les modes de transmission aéroportée influencent la conception des systèmes de stérilisation. La transmission par gouttelettes (>5 μm) nécessite des débits de traitement élevés et une capture rapide avant sédimentation gravitaire. La transmission par aérosols (<5 μm) impose un traitement continu du volume d’air ambiant, ces particules restant en suspension plusieurs heures. La transmission par contact indirect via surfaces contaminées justifie l’intégration de fonctions de décontamination des surfaces dans certains dispositifs.
Les mécanismes d’inactivation microbienne exploitent les vulnérabilités spécifiques des agents pathogènes. L’irradiation UV-C (254 nm) provoque des liaisons covalentes dans l’ADN/ARN microbien (dimères de pyrimidine), bloquant la réplication. L’oxydation par radicaux hydroxyles (OH·) détruit les membranes cellulaires par peroxydation lipidique. L’ionisation bipolaire génère des espèces réactives perturbant l’intégrité membranaire. La photocatalyse produit simultanément plusieurs espèces oxydantes (OH·, O₂·⁻, H₂O₂) pour une action synergique.
Dose d’inactivation UV-C (254 nm) pour réduction 3 log₁₀ :
- Virus enveloppés : 3-10 mJ/cm² (SARS-CoV-2, Influenza)
- Virus non enveloppés : 30-100 mJ/cm² (Norovirus, Adénovirus)
- Bactéries végétatives : 8-25 mJ/cm² (E. coli, S. aureus)
- Mycobactéries : 40-80 mJ/cm² (M. tuberculosis)
- Spores bactériennes : 120-300 mJ/cm² (B. subtilis, C. difficile)
- Champignons : 15-50 mJ/cm² (Aspergillus, Candida)
2. Champ d’Application
2.1 Secteur Hospitalier
Les blocs opératoires représentent l’application la plus exigeante en matière de stérilisation de l’air, nécessitant un environnement de classe ISO 5 selon la norme ISO 14644-1. Cette classification impose une concentration particulaire maximale de 3 520 particules/m³ de taille ≥0,5 μm et une contamination microbienne <1 UFC/m³. Les stérilisateurs d’air, intégrés aux systèmes de traitement d’air ou déployés en unités autonomes, contribuent au maintien de ces exigences critiques, particulièrement lors d’interventions à risque infectieux élevé (chirurgie orthopédique prothétique, neurochirurgie, transplantation).
Les services d’hématologie-oncologie constituent une application prioritaire du fait de la vulnérabilité extrême des patients immunodéprimés. Les chambres d’isolement protecteur requièrent une filtration HEPA H14 (99,995% @0,3 μm) complétée par stérilisation UV-C ou photocatalytique pour éliminer les pathogènes opportunistes. L’objectif consiste à maintenir une contamination microbienne <0,1 UFC/m³, niveau compatible avec la protection des patients en aplasie post-chimiothérapie ou post-greffe de moelle osseuse.
Les unités de soins intensifs, environnements à forte densité microbienne du fait de la gravité des pathologies traitées, bénéficient significativement de la stérilisation d’air. Ces services, présentant des taux d’infections nosocomiales de 15-25% selon l’European Centre for Disease Prevention and Control, voient leur incidence infectieuse réduite de 30-40% par déploiement de technologies de stérilisation active. L’impact est particulièrement marqué sur les pneumonies acquises sous ventilation mécanique, première cause d’infection nosocomiale en réanimation.
Les salles d’accouchement et services de néonatologie justifient des mesures de stérilisation d’air spécifiques du fait de l’immaturité immunitaire des nouveau-nés. Les infections néonatales précoces, souvent d’origine environnementale, peuvent être prévenues par maintien d’un air de qualité pharmaceutique (classe D minimum selon GMP). Cette exigence impose généralement l’association filtration HEPA et stérilisation UV-C ou photocatalytique, avec monitoring microbiologique continu.
Les services de maladies infectieuses requièrent une approche bidirectionnelle : protection du personnel soignant contre les pathogènes émis par les patients, et protection des patients contre les surinfections nosocomiales. Cette double exigence justifie le déploiement de stérilisateurs d’air en extraction (traitement air vicié) et en apport (protection air neuf), avec adaptation des technologies selon les pathogènes traités : UV-C pour tuberculose, plasma froid pour virus respiratoires, photocatalyse pour bactéries multirésistantes.
2.2 Industrie Pharmaceutique
Les salles blanches pharmaceutiques, classées selon les Bonnes Pratiques de Fabrication (GMP) en grades A, B, C et D, constituent le champ d’application le plus réglementé de la stérilisation d’air. Les zones de grade A, dédiées aux opérations aseptiques critiques (remplissage, bouchage), exigent un air de qualité stérile avec contamination microbienne <1 UFC/m³. Cette performance, inatteignable par filtration seule, nécessite l’intégration de stérilisation UV-C haute intensité ou plasma froid validés selon les référentiels FDA et EMA.
Les zones aseptiques de production, cœur de la fabrication pharmaceutique stérile, intègrent systématiquement des technologies de stérilisation d’air pour garantir la conformité aux standards GMP. L’approche multicouches associe filtration HEPA terminale, stérilisation UV-C en flux laminaire, et traitement photocatalytique de l’air de dilution. Cette redondance technologique, imposée par les enjeux économiques (lots de plusieurs millions d’euros) et sanitaires, assure une robustesse maximale du système de maîtrise de la contamination.
Classification GMP pharmaceutique et exigences air :
- Grade A : <1 UFC/m³, stérilisation active obligatoire, flux laminaire ISO 5
- Grade B : <10 UFC/m³, stérilisation recommandée, environnement grade A
- Grade C : <100 UFC/m³, filtration HEPA + stérilisation optionnelle
- Grade D : <500 UFC/m³, traitement air standard avec surveillance
Les laboratoires de contrôle qualité pharmaceutique, manipulant quotidiennement des échantillons potentiellement contaminés, nécessitent une protection environnementale spécifique. Les postes de travail sous flux laminaire intègrent des modules de stérilisation UV-C pour éviter les contaminations croisées entre échantillons. Cette précaution, critique pour la validité des analyses microbiologiques, prévient les faux positifs pouvant invalider des lots entiers de production.
Les isolateurs pharmaceutiques, enceintes de confinement utilisées pour manipulations aseptiques, constituent une application de pointe de la stérilisation d’air. Ces équipements intègrent des systèmes de décontamination par peroxyde d’hydrogène vaporisé (VH₂O₂) ou plasma froid pour cycles de stérilisation complets. L’efficacité requise (6 log₁₀ minimum) impose des validations microbiologiques exhaustives selon les standards ISO 14937, avec challenge tests utilisant des spores de Geobacillus stearothermophilus.
2.3 Laboratoires de Recherche
Les laboratoires de microbiologie de niveau de sécurité biologique P2, P3 et P4 imposent des exigences graduées de stérilisation d’air pour prévenir la dissémination d’agents pathogènes. Les laboratoires P2 (pathogènes modérément dangereux) utilisent généralement des stérilisateurs UV-C en extraction pour traiter l’air vicié. Les laboratoires P3 (pathogènes à transmission aérienne) exigent une stérilisation bidirectionnelle avec filtres HEPA et UV-C haute intensité. Les laboratoires P4 (agents de guerre biologique) intègrent des systèmes redondants avec filtration HEPA multiple et stérilisation plasma ou VH₂O₂.
Les salles de culture cellulaire, environnements ultrasensibles à la contamination microbienne, nécessitent un air de qualité pharmaceutique pour préserver l’intégrité des lignées cellulaires. La contamination par mycoplasmes, champignons ou bactéries peut détruire des mois de travail de recherche et compromettre la validité des résultats. Les stérilisateurs photocatalytiques, efficaces contre les contaminants les plus résistants sans générer de résidus toxiques, constituent la solution de référence pour ces applications.
Les animaleries SPF (Specific Pathogen Free), dédiées à l’élevage d’animaux de laboratoire exempts d’agents pathogènes spécifiques, constituent une application spécialisée de la stérilisation d’air. Ces installations maintiennent des environnements contrôlés avec contamination microbienne quasi-nulle pour préserver le statut sanitaire des animaux. L’approche technique associe surpression, filtration HEPA H14, stérilisation UV-C continue, et monitoring microbiologique permanent selon les standards internationaux FELASA.
2.4 Autres Applications
Les cabinets dentaires représentent un marché émergent significatif pour les stérilisateurs d’air, particulièrement depuis la pandémie de COVID-19 qui a révélé les risques de transmission par aérosols générés lors des soins. Les procédures dentaires (détartrage, fraisage, aspiration) produisent des bioaérosols chargés en salive et sang pouvant véhiculer des pathogènes (VHB, VHC, SARS-CoV-2). Les stérilisateurs UV-C mobiles ou muraux permettent une décontamination inter-patients efficace, réduisant de 85-95% la charge microbienne selon les études de l’American Dental Association.
Les établissements d’hébergement pour personnes âgées dépendantes (EHPAD) constituent une application croissante justifiée par la vulnérabilité de cette population aux infections respiratoires. Les épidémies de grippe, rhinovirus, ou SARS-CoV-2 en collectivités gériatriques présentent une morbi-mortalité élevée (15-30% selon Santé Publique France). Les stérilisateurs d’air portables ou intégrés aux systèmes de ventilation permettent une prévention active, particulièrement efficace dans les espaces communs (salles de restauration, d’activités, de kinésithérapie).
L’industrie agroalimentaire, notamment les zones de fabrication aseptique (produits laitiers UHT, conserves stérilisées), intègre progressivement des technologies de stérilisation d’air pour améliorer la sécurité microbiologique. Ces applications, régies par les standards HACCP et BRC, visent la prévention des contaminations post-traitement thermique. Les stérilisateurs photocatalytiques, compatibles avec les environnements humides et les variations thermiques, constituent la solution technique privilégiée.
Le secteur biotechnologique, incluant la production de vaccins, thérapies géniques et cellulaires, impose des exigences de stérilisation d’air comparables au pharmaceutique. Les bioréacteurs, fermenteurs, et systèmes de purification nécessitent un air stérile pour éviter les contaminations compromettant des productions de haute valeur ajoutée. L’intégration de stérilisation plasma froid ou UV-C LED permet d’atteindre les performances requises tout en optimisant la consommation énergétique et la maintenance.
3. Caractéristiques de Conception
3.1 Composants Principaux
Le ventilateur ou turbine constitue le cœur hydraulique du stérilisateur d’air, dimensionné pour assurer le débit nominal tout en surmontant les pertes de charge du système de traitement. Les ventilateurs centrifuges, privilégiés pour leur efficacité énergétique et leur faible niveau sonore, développent des pressions de 200-800 Pa selon la complexité du traitement. Les moteurs à commutation électronique (brushless DC) optimisent la consommation énergétique et permettent la variation de vitesse pour adaptation aux besoins instantanés.
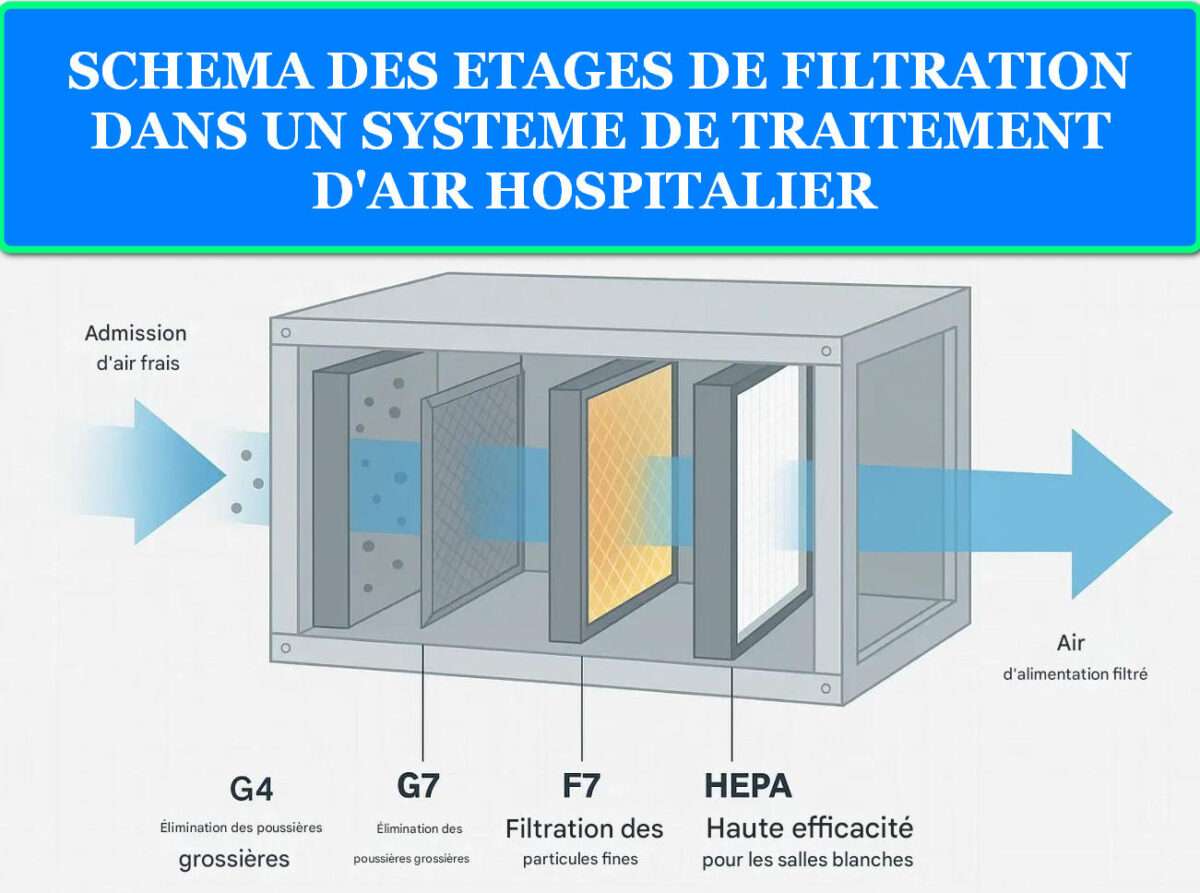
Le système de filtration mécanique assure la capture des particules et la protection des modules de stérilisation aval. L’architecture typique comprend un pré-filtre G4 (particules >10 μm), un filtre intermédiaire F7-F9 (particules 1-10 μm), et un filtre terminal HEPA H13/H14 (particules >0,3 μm). Cette stratification optimise la durée de vie des filtres coûteux et garantit une qualité d’air constante. Les filtres à charbon actif complètent le dispositif pour l’élimination des composés organiques volatils et odeurs.
Architecture type système filtration multi-étages :
- Pré-filtre G4 : Particules >10 μm, protection amont, lavable
- Filtre F8 : Particules 1-10 μm, efficacité moyenne 90%
- Filtre HEPA H14 : Particules >0,3 μm, efficacité 99,995%
- Module stérilisation : UV-C, photocatalyse, plasma selon application
- Filtre charbon actif : COV, odeurs, protection aval optionnelle
Le module de stérilisation, cœur technologique du dispositif, intègre la technologie d’inactivation microbienne sélectionnée selon l’application. Les chambres d’irradiation UV-C utilisent des lampes basse pression (254 nm) ou LED UV-C (265-280 nm) optimisées pour maximiser la dose germicide. Les réacteurs photocatalytiques associent catalyseur TiO₂ et irradiation UV-A (365 nm) pour générer des radicaux hydroxyles. Les générateurs de plasma froid produisent des espèces réactives (O₃, NO, OH·) par décharge électrique contrôlée.
Les capteurs de qualité d’air permettent le monitoring temps réel des performances et l’adaptation automatique du traitement. Les compteurs de particules laser (0,3-10 μm) quantifient l’efficacité de filtration. Les capteurs de COV (photo-ionisation ou semiconducteur) évaluent l’élimination des polluants gazeux. Les moniteurs microbiologiques (impaction ou fluorescence) fournissent une évaluation directe de l’efficacité de stérilisation. Cette instrumentation permet l’optimisation énergétique et la maintenance prédictive.
Le système de contrôle et monitoring centralise la gestion opérationnelle et assure la traçabilité réglementaire. Les automates programmables industriels (API) gèrent les séquences de fonctionnement, les alarmes, et les interfaces utilisateur. La connectivité IoT (Internet des Objets) permet la supervision à distance, la maintenance prédictive, et l’intégration aux systèmes de gestion technique du bâtiment (GTB). Les enregistreurs de données (dataloggers) archivant les paramètres critiques assurent la conformité aux exigences de traçabilité pharmaceutique et hospitalière.
3.2 Paramètres de Performance
Le CADR (Clean Air Delivery Rate) quantifie le débit d’air effectivement décontaminé par le stérilisateur, exprimé en m³/h. Ce paramètre, standardisé par l’Association of Home Appliance Manufacturers (AHAM), intègre simultanément le débit volumique et l’efficacité d’élimination. Un CADR de 400 m³/h signifie que le dispositif traite effectivement 400 m³ d’air par heure à l’efficacité nominale. Les stérilisateurs médicaux présentent des CADR de 200-2000 m³/h selon leur dimensionnement et destination.
L’ACH (Air Changes per Hour) exprime le nombre de renouvellements du volume d’air ambiant par heure, paramètre critique pour dimensionner l’installation. Le calcul ACH = CADR/Volume local permet d’adapter la puissance du stérilisateur au volume à traiter. Les recommandations hospitalized varient selon l’application : 6-12 ACH pour chambres patients standard, 15-25 ACH pour blocs opératoires, 12-20 ACH pour services immunodéprimés. Cette approche volumétrique assure une décontamination homogène de l’environnement.
Paramètres de performance clés :
- CADR : 200-2000 m³/h selon application (standard AHAM-AC-1)
- ACH : 6-25 renouvellements/heure selon niveau critique
- Efficacité filtration : 99,97-99,9995% @0,3 μm (HEPA H13-U15)
- Réduction microbienne : 2-6 log₁₀ selon technologie stérilisation
- Niveau sonore : 35-55 dB(A) selon débit et conception
- Consommation : 50-500 W selon puissance et technologies intégrées
L’efficacité de filtration, mesurée selon la norme EN 1822, quantifie la capacité de rétention particulaire des filtres HEPA/ULPA. Les filtres H13 (99,95% @0,3 μm) équipent les applications standard, les H14 (99,995%) les environnements critiques, et les U15 (99,9995%) les applications pharmaceutiques de grade A. Cette graduation permet l’adaptation précise aux exigences de contamination particulaire selon les normes ISO 14644 de classification des salles blanches.
L’efficacité d’inactivation microbienne, exprimée en réduction logarithmique, caractérise la performance du module de stérilisation. Les technologies UV-C atteignent 3-4 log₁₀ (99,9-99,99%) à débit nominal, la photocatalyse 2-3 log₁₀, l’ionisation bipolaire 1-2 log₁₀, et le plasma froid 4-5 log₁₀. Cette performance, validée par tests microbiologiques selon les normes ASTM E2197 ou NF T72-281, conditionne le choix technologique selon l’application visée.
Le niveau sonore, paramètre critique pour l’acceptabilité en environnement médical, varie de 35 dB(A) (équivalent chuchotement) à 55 dB(A) (conversation normale) selon la conception. Les technologies silencieuses privilégient les ventilateurs centrifuges à faible vitesse, les pièges à son dans les conduits, et l’isolation vibratoire des moteurs. Cette caractéristique conditionne l’usage continu, particulièrement important pour les chambres de patients et espaces de soins.
3.3 Normes et Certifications
La norme EN 1822 « Filtres à air à très haute efficacité (HEPA et ULPA) » établit les méthodes d’essai et classification des filtres terminaux utilisés dans les stérilisateurs d’air. Cette norme définit 17 classes de filtres (E10 à U17) selon leur efficacité de filtration et leur perte de charge. Les essais normalisés (pénétration d’huile de paraffine, comptage particulaire, résistance mécanique) garantissent des performances reproductibles et la traçabilité métrologique des équipements.
L’ISO 14644 « Salles propres et environnements maîtrisés apparentés » fournit le référentiel de classification de la propreté particulaire et microbienne. Cette norme établit 9 classes de propreté (ISO 1 à ISO 9) selon la concentration particulaire admissible, orientant le choix des stérilisateurs d’air. Les méthodes de surveillance (comptage particulaire, échantillonnage microbiologique, tests de qualification) standardisent les protocoles de validation et de maintenance des installations.
• EN 1822:2019 – Filtres HEPA/ULPA classification et essais
• ISO 14644:2015 – Classification salles propres et environnements contrôlés
• NFS 90-351:2020 – Traitement d’air établissements de santé (France)
• ASTM E2197:2011 – Évaluation efficacité désinfectants air
• IEC 62471:2006 – Sécurité photobiologique équipements UV
• UL 2998:2019 – Certification zéro émission ozone
• CE 93/42/CEE – Directive dispositifs médicaux (Europe)
La norme française NFS 90-351 « Établissements de santé – Traitement d’air – Salles propres et environnements maîtrisés apparentés » constitue la référence européenne pour les applications hospitalières. Cette norme spécifie les exigences de conception, réalisation, et maintenance des systèmes de traitement d’air, incluant les dispositifs de stérilisation. Les prescriptions techniques (débits, filtration, surpression, monitoring) orientent directement les spécifications des stérilisateurs d’air médicaux.
La certification CE médicale selon la directive 93/42/CEE (remplacée par le règlement MDR 2017/745) s’impose pour la commercialisation européenne des stérilisateurs d’air à usage médical. Cette certification implique la classification en classe I (faible risque) ou IIa (risque modéré), l’établissement d’un dossier technique complet, et la mise en place d’un système qualité ISO 13485. La surveillance post-commercialisation et la matériovigilance complètent les obligations réglementaires.
La certification UL 2998 « Validation zéro émission ozone » garantit l’absence de production d’ozone par les dispositifs de purification d’air. Cette certification, particulièrement importante pour les technologies d’ionisation et plasma, impose des tests d’émission en conditions d’usage normal et de défaillance prévisible. Le seuil maximal admis (5 ppb) assure la compatibilité avec les environnements occupés en continu selon les standards de l’EPA américaine.
3.4 Critères de Sélection
Le volume de la pièce à traiter constitue le premier paramètre de dimensionnement, déterminant le débit minimal requis selon les objectifs de renouvellement d’air. Le calcul CADR = Volume × ACH cible permet d’établir la puissance nécessaire. Une marge de sécurité de 20-30% compense les pertes de performance liées au vieillissement des filtres et modules de stérilisation. Cette approche conservative assure le maintien des performances sur la durée de vie de l’équipement.
Le niveau de contamination initial influence directement le choix technologique et le dimensionnement. Les environnements fortement contaminés (urgences, consultation infectiologie) nécessitent des stérilisateurs haute performance avec technologies multiples (HEPA + UV-C + photocatalyse). Les environnements propres (blocs opératoires, pharmacie) peuvent s’accommoder de solutions plus simples (HEPA + UV-C) optimisant les coûts d’investissement et d’exploitation.

Les types de micro-organismes ciblés orientent le choix de la technologie de stérilisation selon les spectres d’efficacité spécifiques. Les virus enveloppés (grippe, SARS-CoV-2) sont sensibles à toutes les technologies. Les virus non enveloppés (norovirus, adénovirus) nécessitent des doses UV-C élevées ou photocatalyse. Les spores bactériennes (C. difficile) exigent plasma froid haute intensité ou UV-C prolongée. Cette analyse microbiologique guide la sélection technologique optimale.
Les contraintes d’installation déterminent la configuration (portable, murale, plafonnière, intégrée HVAC) et les spécifications techniques (alimentation électrique, encombrement, niveau sonore, maintenance). Les installations existantes orientent vers des solutions autonomes. Les constructions neuves permettent l’intégration centralisée optimisant l’efficacité et les coûts d’exploitation. L’accessibilité pour maintenance conditionne la facilité d’exploitation à long terme.
Le budget d’investissement et de maintenance influence la stratégie technologique selon l’équation coût-efficacité. Les solutions HEPA + ionisation présentent des coûts d’investissement réduits (1000-3000€) mais des performances limitées. Les systèmes HEPA + UV-C + photocatalyse offrent des performances optimales (3-5 log₁₀) pour 5000-15 000€ d’investissement. L’analyse du coût total de possession (TCO) sur 10 ans intégrant maintenance, consommables, et énergie oriente les décisions d’investissement.
4. Types de Stérilisateurs d’Air – Technologies
4.1 Stérilisateurs à Filtration HEPA/ULPA
Le principe de filtration mécanique exploite les mécanismes physiques de capture particulaire : impaction inertielle pour les grosses particules (>1 μm), interception directe pour les particules moyennes (0,3-1 μm), et mouvement brownien pour les nanoparticules (<0,3 μm). Cette approche multicouche assure une efficacité maximale à 0,3 μm (MPPS – Most Penetrating Particle Size), taille de référence pour la classification HEPA. L’absence de production de sous-produits chimiques ou d’ozone constitue un avantage majeur pour les environnements occupés en continu.
Les filtres HEPA H13, certifiés 99,95% @0,3 μm selon EN 1822, équipent la majorité des applications hospitalières standard. Leur efficacité, validée par test DOP (dioctylphtalate) ou PAO (huile de paraffine), garantit la capture des bactéries, virus, et spores de taille supérieure à 0,1 μm. La perte de charge initiale (150-300 Pa) et l’évolution en service (colmatage progressif) conditionnent la conception des ventilateurs et la fréquence de remplacement (6-12 mois selon usage).
HEPA H13 (99,95%)
- Applications : Chambres patients, consultations
- Débit : 200-800 m³/h
- Perte charge : 150-250 Pa
- Durée vie : 6-12 mois
HEPA H14 (99,995%)
- Applications : Blocs opératoires, oncologie
- Débit : 300-1200 m³/h
- Perte charge : 200-300 Pa
- Durée vie : 8-15 mois
ULPA U15 (99,9995%)
- Applications : Salles blanches classe A
- Débit : 500-1500 m³/h
- Perte charge : 250-400 Pa
- Durée vie : 12-18 mois
Les filtres HEPA H14 (99,995% @0,3 μm) répondent aux exigences des environnements critiques (blocs opératoires, services immunodéprimés). Leur efficacité renforcée assure la capture de 99,999% des particules de 0,1 μm, incluant la plupart des virus respiratoires. La conception plissée optimise la surface filtrante (15-25 m² pour un filtre 610×610×292 mm) tout en minimisant la perte de charge. L’intégration de séparateurs aluminium ou plastique prévient le flambage du média filtrant sous contrainte.
Les filtres ULPA U15 (99,9995% @0,3 μm) constituent la référence pour les applications pharmaceutiques de grade A et les laboratoires P4. Leur efficacité exceptionnelle capture 99,99995% des particules de 0,1 μm, approchant les performances de stérilisation. La technologie de média ultra-fin (fibres submicroniques) et la construction renforcée garantissent l’intégrité structurelle sous hautes contraintes. Les tests d’intégrité par DOP (0,3 μm) ou sodium (0,6 μm) valident l’absence de fuites compromettantes.
Les avantages de la filtration HEPA/ULPA incluent l’efficacité prouvée (60 ans d’usage hospitalier), l’absence de sous-produits chimiques, la compatibilité avec tous environnements, et la simplicité d’exploitation. Les inconvénients comprennent l’absence d’inactivation microbienne (pathogènes viables dans filtres usagés), la saturation progressive, les coûts de remplacement élevés, et la production de déchets contaminés nécessitant incinération.
4.2 Stérilisateurs UV-C (Ultraviolets Germicides)
L’irradiation UV-C à 254 nm exploite l’absorption maximale de l’ADN microbien pour provoquer des dommages létaux. Les photons UV-C induisent des liaisons covalentes entre bases pyrimidiques adjacentes (dimères de thymine), bloquant la transcription et la réplication. Cette action directe sur le matériel génétique assure l’inactivation de tous types de micro-organismes (virus, bactéries, champignons, spores) sans développement de résistance. L’efficacité dépend de la dose appliquée (Intensité × Temps d’exposition) et de l’accessibilité des cibles.
La dose germicide, exprimée en mJ/cm², quantifie l’énergie UV-C nécessaire pour obtenir une réduction logarithmique donnée. Les virus enveloppés (grippe, SARS-CoV-2) nécessitent 3-10 mJ/cm² pour 3 log₁₀, les bactéries végétatives 8-25 mJ/cm², et les spores 120-300 mJ/cm². Cette graduation permet l’adaptation précise de l’installation selon les pathogènes ciblés. Les lampes basse pression mercure (254 nm) délivrent 30-40% de leur puissance en UV-C germicide.
Types de systèmes UV-C pour stérilisation d’air :
- UV-C en flux : Chambre d’irradiation dans circuit air, 50-200 mJ/cm²
- UV-C upper room : Irradiation zone haute, convection naturelle
- UV-C mobile : Chariots décontamination, 500-2000 mJ/cm²
- UV-C LED : Diodes 265-280 nm, commande électronique
Les systèmes UV-C en flux d’air intègrent des chambres d’irradiation dans les circuits de ventilation pour traiter l’air en mouvement. Cette configuration optimise l’efficacité énergétique et permet un traitement continu sans exposition du personnel. Les chambres sont dimensionnées pour assurer un temps de séjour suffisant (0,5-2 secondes) à l’obtention de la dose germicide cible. Les réflecteurs aluminium anodisé ou acier inoxydable poli optimisent la distribution d’intensité et minimisent les zones d’ombre.
Les systèmes UV-C « upper room » installent des luminaires en partie haute des locaux pour créer une zone de décontamination par convection naturelle. L’air chaud montant traverse la zone irradiée puis redescend décontaminé par convection thermique. Cette approche, validée par les CDC américains, assure une réduction de 80-90% de la contamination aéroportée sans exposition directe des occupants. L’efficacité dépend du taux de brassage (convection) et de la puissance UV-C installée (0,5-2 W/m³).

Les avantages de la stérilisation UV-C incluent l’inactivation directe sans filtres consommables, l’efficacité immédiate, l’absence de résidus chimiques, et la compatibilité avec tous débits d’air. Les inconvénients comprennent la nécessité de maintenance des lampes (8000-12 000h), la sensibilité aux ombres portées, le risque d’exposition accidentelle (érythème, conjonctivite), et la production d’ozone par certaines lampes (longueurs d’onde <240 nm).
Les coûts d’investissement varient de 1500€ (unités portables 30W) à 8000€ (systèmes intégrés 200W) selon la puissance et la sophistication. Les coûts d’exploitation incluent la consommation électrique (100-500 kWh/an) et le remplacement des lampes (100-500€/an). L’analyse économique révèle des coûts d’exploitation inférieurs à la filtration HEPA sur 5 ans, particulièrement pour les applications à débit élevé.
4.3 Stérilisateurs Photocatalytiques
La photocatalyse exploite les propriétés semi-conductrices du dioxyde de titane (TiO₂) pour générer des espèces réactives oxygénées sous irradiation UV-A (365 nm). L’absorption photonique promeut des électrons de la bande de valence vers la bande de conduction, créant des paires électron-trou. Ces charges réagissent avec l’oxygène et la vapeur d’eau atmosphériques pour produire des radicaux hydroxyles (OH·), anions superoxydes (O₂·⁻), et peroxyde d’hydrogène (H₂O₂). Cette « chimie douce » détruit les micro-organismes par oxydation des membranes cellulaires et de l’ADN.

