Blog
LA STÉRILISATION EN AUTOCLAVE :
PRINCIPES, MÉTHODES ET BONNES PRATIQUES
Guide Complet International – Europe, États-Unis, Japon
Document Technique Professionnel
Octobre 2024 – Version 1.0
TABLE DES MATIÈRES
- Introduction
- Chapitre 1 : Principes Fondamentaux de la Stérilisation par Autoclave
- Chapitre 2 : Types d’Autoclaves et Méthodes
- Chapitre 3 : Normes et Réglementations Internationales
- Chapitre 4 : Validation des Procédés
- Chapitre 5 : Bonnes Pratiques Opérationnelles
- Chapitre 6 : Applications Spécifiques
- Chapitre 7 : Traçabilité et Documentation
- Chapitre 8 : Tendances et Perspectives
- Conclusion
- Références
INTRODUCTION
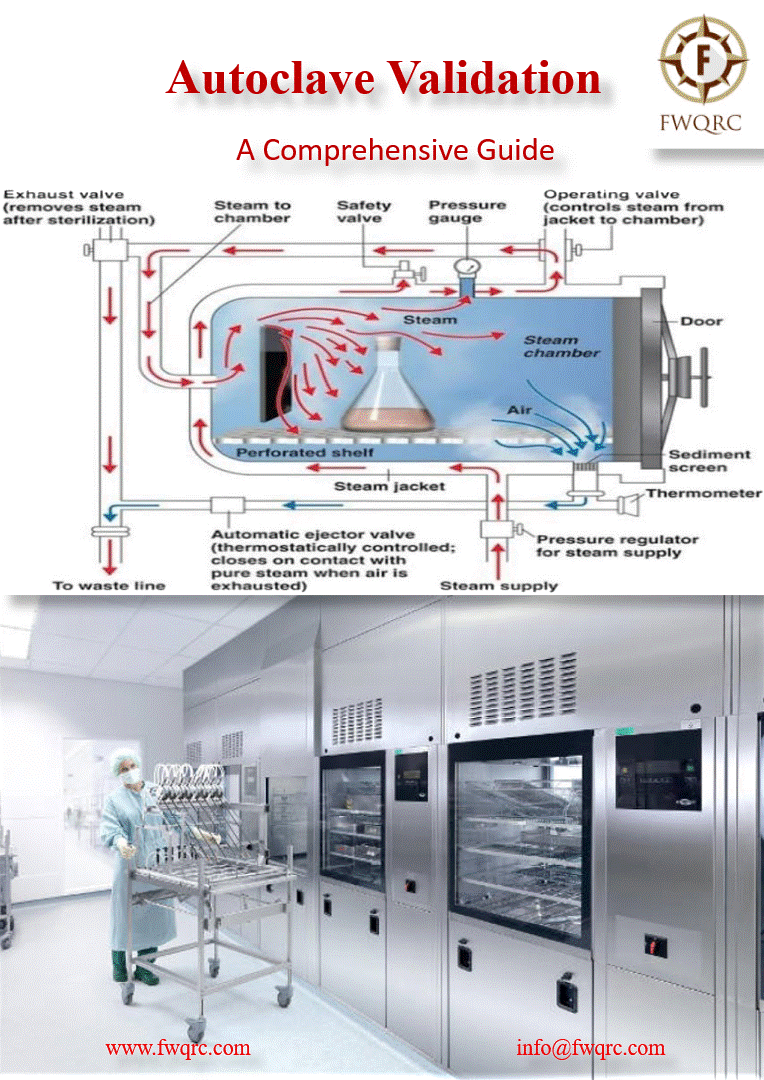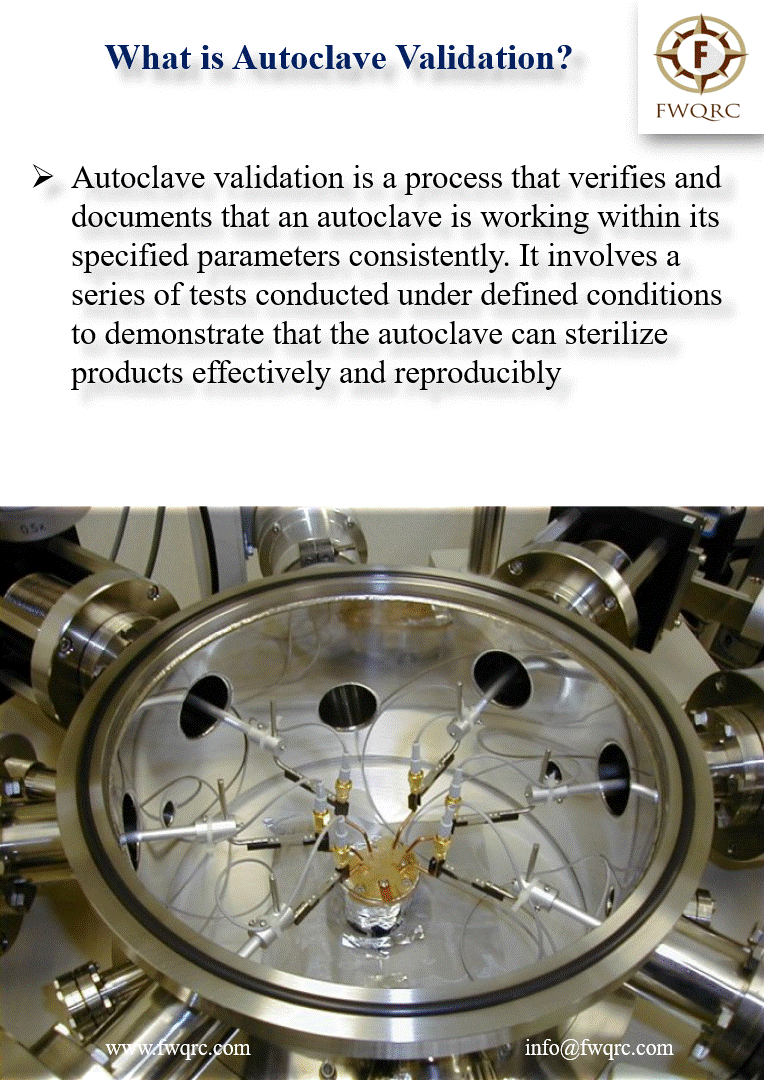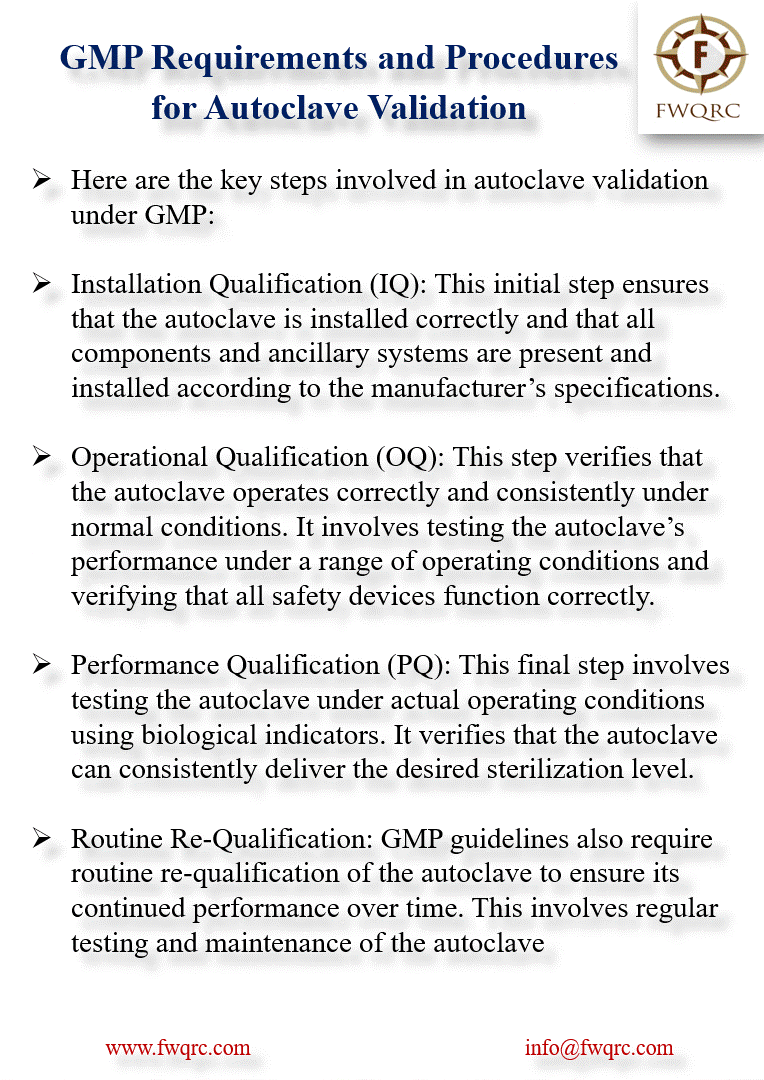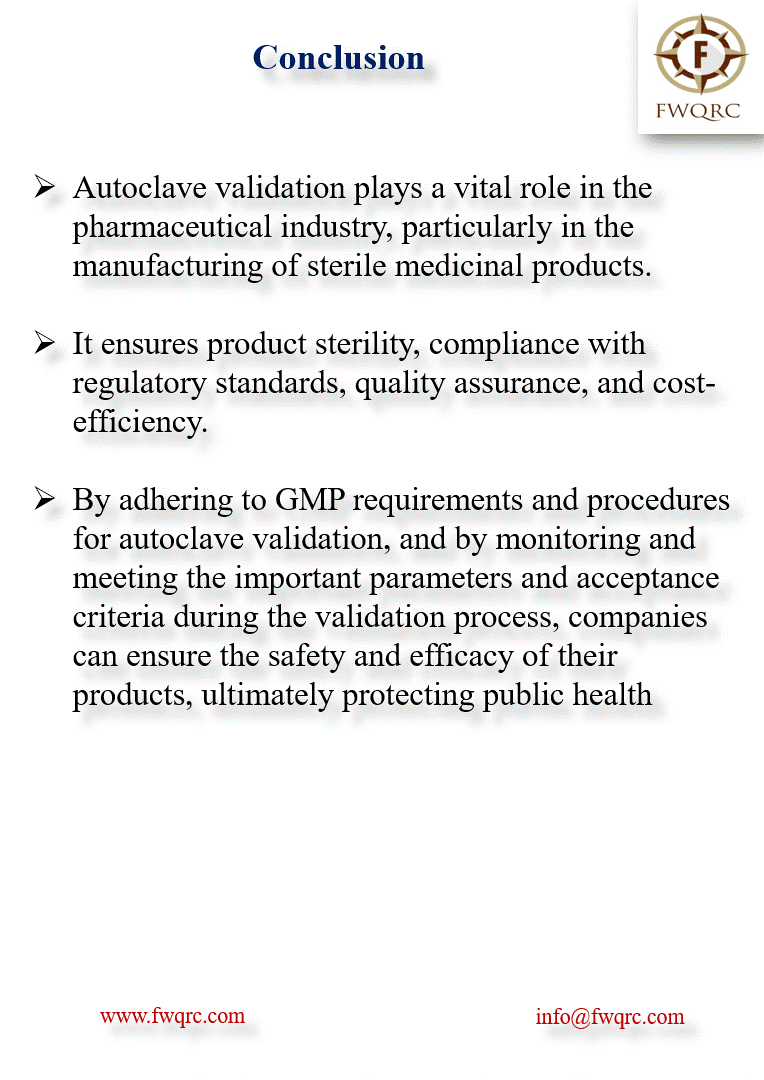
La stérilisation en autoclave constitue aujourd’hui l’une des pierres angulaires de la sécurité microbiologique dans les secteurs médical, pharmaceutique et de la recherche biomédicale. Cette technologie, qui repose sur l’utilisation de vapeur saturée sous pression, représente la méthode de référence pour l’inactivation des microorganismes, y compris les formes sporulées les plus résistantes.
Autoclave médical moderne dans un établissement de santé
Contexte Historique et Évolution
L’histoire de la stérilisation par autoclave débute en 1879 avec les travaux pionniers de Charles Chamberland, collaborateur de Louis Pasteur. Son invention révolutionne la microbiologie en permettant pour la première fois d’obtenir des milieux de culture stériles de façon reproductible. Depuis cette époque, la technologie n’a cessé d’évoluer :
- 1886 : Premier autoclave hospitalier par Ernst von Bergmann à Berlin
- 1930-1950 : Développement des autoclaves à vide préalable
- 1970-1990 : Automatisation et contrôle électronique des cycles
- 2000-2020 : Intégration des systèmes informatisés de traçabilité
- 2020-2024 : Émergence des autoclaves connectés (IoT) et intelligence artificielle
Enjeux Contemporains de Santé Publique
Dans un contexte où les infections nosocomiales touchent 5 à 10% des patients hospitalisés en Europe et représentent la 4ème cause de mortalité aux États-Unis, la stérilisation des dispositifs médicaux réutilisables (DMR) revêt une importance critique. Les statistiques européennes révèlent que :
- Plus de 2,6 milliards de cycles de stérilisation sont réalisés annuellement en Europe
- 300 millions d’instruments chirurgicaux sont traités chaque année en France
- Le marché mondial des autoclaves représente 3,2 milliards USD en 2024
- La stérilisation inadéquate est impliquée dans 15% des infections du site opératoire
Évolution des Normes Internationales
L’harmonisation progressive des standards internationaux constitue un enjeu majeur. La récente publication de la norme ISO 17665:2024 marque une étape importante dans la convergence des pratiques entre l’Europe, les États-Unis et le Japon. Cette convergence facilite :
- Les échanges commerciaux d’équipements et de services
- La reconnaissance mutuelle des validations
- Le partage des meilleures pratiques
- L’amélioration globale de la sécurité des patients
📊 DONNÉES CLÉS MONDIALES
• Europe : 28 000 établissements de santé équipés d’autoclaves
• États-Unis : 6 090 hôpitaux avec plus de 180 000 autoclaves
• Japon : 8 400 établissements hospitaliers, leader technologique mondial
• Croissance : +4,2% par an du marché mondial jusqu’en 2030
Ce guide technique se propose d’analyser de manière exhaustive les principes, méthodes et bonnes pratiques de la stérilisation en autoclave, en s’appuyant sur les retours d’expérience des trois principales zones géographiques et réglementaires que sont l’Europe, les États-Unis et le Japon.
CHAPITRE 1 : PRINCIPES FONDAMENTAUX DE LA STÉRILISATION PAR AUTOCLAVE
1.1 Définition et Concept de Stérilité
Selon la norme ISO 11139:2018, la stérilité se définit comme l’« état d’un produit exempt de microorganismes viables ». Cette définition apparemment simple cache une réalité complexe : l’impossibilité d’atteindre une stérilité absolue.
Le Concept Probabiliste de Stérilité
La stérilisation repose sur un concept probabiliste. La cinétique d’inactivation microbienne suit une loi exponentielle, ce qui signifie qu’il subsiste toujours une probabilité infinitésimale qu’un microorganisme survive, même après un traitement prolongé. Cette réalité a conduit à l’établissement du concept de Niveau d’Assurance de Stérilité (NAS).
🔬 NIVEAU D’ASSURANCE DE STÉRILITÉ (NAS)
Le NAS correspond à la probabilité qu’un seul microorganisme viable soit présent sur un article après stérilisation. Il s’exprime sous forme d’exposant négatif en base 10 :
- NAS 10⁻⁶ : 1 chance sur 1 million qu’un microorganisme survive (standard hospitalier)
- NAS 10⁻³ : 1 chance sur 1 000 (désinfection de haut niveau)
- NAS 10⁻¹² : 1 chance sur 1 000 milliards (industrie pharmaceutique critique)
Distinction Désinfection vs Stérilisation
| Critère | Désinfection | Stérilisation |
|---|---|---|
| Objectif | Réduction significative de microorganismes | Élimination totale des microorganismes viables |
| Efficacité sur spores | Variable, souvent insuffisante | Totale |
| NAS | 10⁻² à 10⁻³ | 10⁻⁶ minimum |
| Applications | Surfaces, environnement | Dispositifs médicaux invasifs |
1.2 Principes Physiques Fondamentaux
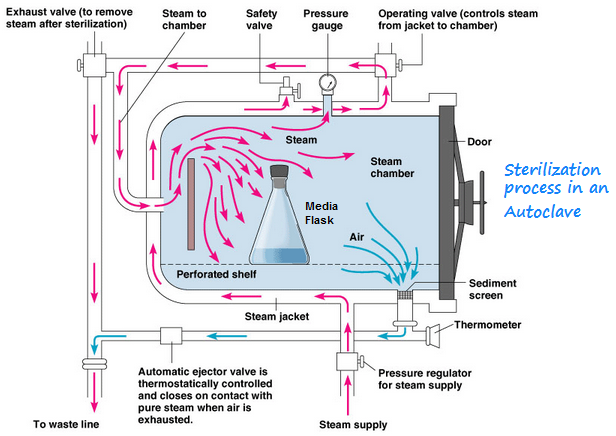
Diagramme des phases de stérilisation en autoclave
Rôle de la Vapeur Saturée
La vapeur saturée constitue l’agent stérilisant de référence car elle combine trois propriétés essentielles :
- Pouvoir de pénétration : La vapeur pénètre dans les moindres interstices
- Transfert thermique optimal : La condensation libère une énergie considérable (chaleur latente = 2260 kJ/kg à 100°C)
- Absence de résidus : L’eau condensée est facilement éliminée
Relation Température-Pression
La relation entre température et pression de la vapeur saturée suit la loi de Clausius-Clapeyron. Cette relation fondamentale explique pourquoi l’augmentation de pression permet d’atteindre des températures élevées nécessaires à la stérilisation :
| Température (°C) | Pression absolue (bar) | Pression relative (bar) | Applications typiques |
|---|---|---|---|
| 121,1 | 2,00 | 1,00 | Textiles, liquides |
| 126,0 | 2,30 | 1,30 | Instruments wrapped |
| 134,0 | 3,00 | 2,00 | Instruments, prion |
| 138,0 | 3,50 | 2,50 | Cycles flash |
Mécanisme de Destruction Microbienne
L’action létale de la chaleur humide résulte de plusieurs mécanismes synergiques :
- Coagulation des protéines : Dénaturation irréversible des enzymes vitales
- Fusion des lipides membranaires : Perte de l’intégrité cellulaire
- Hydrolyse de l’ADN : Destruction du matériel génétique
- Inactivation des systèmes enzymatiques : Arrêt du métabolisme cellulaire
1.3 Paramètres Critiques de Stérilisation
L’efficacité d’un cycle de stérilisation dépend de la maîtrise simultanée de quatre paramètres critiques interdépendants :
| Paramètre | Plage Standard | Norme Européenne (EN 285) | FDA (USA) | JMHLW (Japon) |
|---|---|---|---|---|
| Température | 121-134°C | 121,1°C ± 2°C 134°C ± 3°C | 121°C minimum Selon FDA Guidelines | 121,1°C ± 1,5°C JP Requirements |
| Pression | 1-3 bars (relatif) | 1,0-3,0 bars | 15-30 psi (1,0-2,1 bars) | 0,1-0,3 MPa (1,0-3,0 bars) |
| Temps d’exposition | 3-60 minutes | Selon charge et F₀ | Selon validation | Selon pharmacopée JP |
| Humidité | Vapeur saturée | Sécheresse < 3% | Steam quality ≥ 97% | Vapeur sèche < 3% |
✅ POINTS CLÉS TEMPÉRATURE
• 121,1°C : Température de référence historique (15 psi)
• 134°C : Standard européen pour instruments emballés
• Tolérance : ±2°C maximum pour maintenir l’efficacité
• Homogénéité : Écart ≤ 1°C dans toute la chambre
1.4 Cinétique d’Inactivation et Valeur F₀
La cinétique d’inactivation microbienne suit une loi exponentielle de premier ordre, exprimée par l’équation de Chick :
Où : N = population survivante, N₀ = population initiale, t = temps, D = temps de réduction décimale
Courbes de stérilisation et calcul de valeur F₀
Valeurs D et Z
- Valeur D : Temps nécessaire à 121,1°C pour réduire la population microbienne de 90% (1 log)
- Valeur Z : Variation de température (en °C) nécessaire pour modifier D d’un facteur 10
Pour Geobacillus stearothermophilus (microorganisme de référence) :
- D₁₂₁°C = 1,5 à 2,5 minutes
- Z = 10°C (valeur conventionnelle)
Calcul de la Valeur F₀
La valeur F₀ exprime la létalité totale d’un cycle de stérilisation, ramenée à la température de référence de 121,1°C :
Où T = température instantanée, Δt = intervalle de temps
Exigences Réglementaires F₀
| Région/Application | F₀ Minimum | Référence Normative |
|---|---|---|
| Europe – Dispositifs médicaux | ≥ 8 minutes | ISO 17665:2024 |
| USA – Pharmaceutique (GMP) | ≥ 12 minutes | FDA 21 CFR 211 |
| USA – Dispositifs médicaux | ≥ 8 minutes | AAMI ST79 |
| Japon – Pharmacopée | ≥ 8 minutes | JP 18 |
| Prions (Europe) | ≥ 18 minutes à 134°C | Circulaire DGS |
⚠️ ATTENTION CALCUL F₀
Le calcul de F₀ ne doit inclure que la phase d’exposition où la température est ≥ température de stérilisation. Les phases de montée en température et de refroidissement ne sont comptabilisées que si elles contribuent significativement à la létalité.
CHAPITRE 2 : TYPES D’AUTOCLAVES ET MÉTHODES
2.1 Classification Selon Norme EN 13060
La norme européenne EN 13060:2014 établit une classification fonctionnelle des autoclaves en trois classes principales, basée sur leur capacité à traiter différents types de charges :
Classe N (Naked – « Nu »)
Les autoclaves de classe N utilisent exclusivement le déplacement gravitaire pour l’évacuation de l’air :
- Principe : L’air plus lourd que la vapeur s’évacue naturellement par le bas
- Applications : Instruments solides non emballés, surfaces planes
- Limitations : Inefficace sur corps creux, textiles, articles emballés
- Utilisation typique : Cabinets médicaux, dentaires
📌 EXEMPLE FRANCE – CLASSE N
Dans les 45 000 cabinets dentaires français, 80% utilisent des autoclaves classe N pour les instruments de base (sondes, miroirs). Limitation : nécessité de cycles supplémentaires pour les instruments de chirurgie endodontique (corps creux).
Classe S (Specified – « Spécifiée »)
Classe intermédiaire aux performances définies spécifiquement par le fabricant :
- Applications : Définies et documentées par le constructeur
- Flexibilité : Cycles adaptés à des besoins particuliers
- Validation : Tests spécifiques selon spécifications fabricant
Classe B (Big – « Universel »)
Les autoclaves de classe B représentent le standard hospitalier européen :
- Principe : Élimination forcée de l’air par vide fractionné (3-4 pulses)
- Performance : Évacuation ≥ 99,9% de l’air initial
- Applications universelles : Tous types d’instruments, textiles, emballages
- Tests obligatoires : Bowie-Dick quotidien, étanchéité, performance
Salle de stérilisation moderne avec autoclaves de classe B
2.2 Autoclaves pour Produits Contenus
Ces équipements spécialisés traitent les produits en containers fermés (flacons, ampoules, poches) où la vapeur ne peut entrer en contact direct avec le produit :
Technologies Utilisées
- Spray d’eau surchauffée : Transfert thermique par convection
- Immersion : Bain d’eau à température contrôlée
- Cascade d’air/vapeur : Mélange homogène pour répartition thermique
Applications Pharmaceutiques
- Solutés injectables en flacons verre
- Nutrition parentérale en poches
- Préparations magistrales stériles
- Milieux de culture en laboratoire
2.3 Exemples Internationaux
Europe
🏥 CAS PRATIQUE – CHU DE LYON (FRANCE)
• Équipement : 8 autoclaves Belimed classe B (500L chacun)
• Capacité : 120 UTS/jour (Unités Techniques de Stérilisation)
• Personnel : 52 agents sur site central (3×8)
• Desserte : 2200 lits, 12 blocs opératoires
• Conformité : NF EN 285:2015 + ISO 17665:2024
Charité Berlin (Allemagne) : Installation de référence européenne avec système automatisé STERIS. Particularités :
- 16 autoclaves interconnectés (capacité 300-800L)
- Système de transport pneumatique
- Traçabilité RFID intégrale
- Certification ISO 13485 + MDR 2017/745
États-Unis
🏥 CAS PRATIQUE – KAISER PERMANENTE (CALIFORNIE)
• Réseau : 39 hôpitaux, 250 autoclaves au total
• Standardisation : 80% STERIS, 20% Getinge
• Conformité : FDA 21 CFR Part 820 + AAMI ST79
• Validation : Selon USP <1229> avec requalification annuelle
• Innovations : Système prédictif de maintenance (IA)
Réglementation USA :
- Notification préalable FDA 510(k) pour équipements
- Inspection Joint Commission obligatoire
- Validation selon protocoles AAMI
- Coût conformité : 50 000-100 000 USD/an par établissement
Japon
🏥 CAS PRATIQUE – UNIVERSITÉ DE TOKYO HOSPITAL
• Équipement : 12 autoclaves Sakura + 6 Hirayama
• Spécificités : Validation JMHLW + certification PMDA
• Innovation : Système détection IA des anomalies
• Traçabilité : Obligatoire selon système national
• Conformité : Japanese Pharmacopoeia (JP 18)
Installation pharmaceutique avec autoclaves industriels
2.4 Comparaison des Performances
| Type Autoclave | Durée Cycle (min) | Efficacité Élimination Air | Applications | Coût Relatif | Maintenance |
|---|---|---|---|---|---|
| Classe N | 10-20 | Gravitaire (70-80%) | Très limitée | € | Simple |
| Classe S | 15-35 | Variable selon spécifications | Définie par fabricant | €€ | Modérée |
| Classe B | 20-45 | Vide fractionné (≥99,9%) | Universelle | €€€ | Complexe |
| Produits liquides | 30-120 | N/A | Pharmaceutique exclusivement | €€€€ | Très complexe |
💡 CONSEIL SÉLECTION
Classe N : Réservée aux applications simples (cabinet médical)
Classe B : Standard obligatoire en milieu hospitalier européen
Produits liquides : Uniquement si activité pharmaceutique justifiée
2.5 Évolutions Technologiques Récentes
Autoclaves Connectés (Industry 4.0)
- IoT intégré : Monitoring temps réel via cloud
- Maintenance prédictive : Algorithmes d’apprentissage
- Optimisation énergétique : Réduction 20-30% consommation
- Traçabilité blockchain : Sécurisation données critiques
Innovations Environnementales
- Récupération chaleur : Préchauffage eau d’alimentation
- Vapeur flash : Réduction 50% consommation eau
- Matériaux éco-conçus : Recyclabilité 95% des composants
- Certification ISO 14001 : Management environnemental intégré
CHAPITRE 3 : NORMES ET RÉGLEMENTATIONS INTERNATIONALES
3.1 Cadre Normatif Européen
ISO 17665:2024 – Norme Internationale de Référence
Publiée en mai 2024, cette norme remplace et unifie les précédentes versions (ISO 17665-1:2006, ISO/TS 17665-2:2009, ISO/TS 17665-3:2013). Ses principales caractéristiques :
- Champ d’application élargi : Industriel ET établissements de santé
- Approche risque : Méthodologie basée sur ISO 14971
- Validation renforcée : Exigences IQ/OQ/PQ harmonisées
- Surveillance continue : Contrôle de routine standardisé
📌 NOUVEAUTÉS ISO 17665:2024
• Unification : Document unique remplaçant 3 normes
• Digitalisation : Reconnaissance systèmes informatisés
• Durabilité : Critères environnementaux intégrés
• Applicabilité : Tous secteurs (santé, pharma, recherche)
EN 285:2015 – Autoclaves Grandes Capacités
Cette norme spécifie les exigences pour les autoclaves de volume utile ≥ 60 litres :
- Spécifications techniques : Construction, matériaux, sécurité
- Tests de performance : Protocoles de qualification standardisés
- Qualité vapeur : Critères de pureté (sécheresse, non-condensables)
- Systèmes de contrôle : Exigences pour automatisation
Règlement Européen MDR 2017/745
Le Medical Device Regulation impose de nouvelles obligations :
- Marquage CE renforcé : Évaluation conformité plus stricte
- UDI obligatoire : Identifiant unique dispositifs (depuis mai 2024)
- Traçabilité complète : De la fabrication à l’utilisation finale
- Surveillance post-commercialisation : Système de vigilance renforcé
Processus de développement de cycle selon ISO 17665
Bonnes Pratiques France
Le cadre réglementaire français s’articule autour de plusieurs textes de référence :
- Guide SF2S 2021 : « Bonnes Pratiques de Stérilisation des DMR » – Référentiel professionnel national
- Arrêté BPPH 2001 : Ligne directrice n°1 « Préparation des dispositifs médicaux stériles »
- Certification ISO 9001 : Obligatoire pour unités de stérilisation centralisées
- Décret 2001-1154 : Organisation de la stérilisation en établissements de santé
3.2 Réglementation États-Unis
FDA (Food & Drug Administration)
L’autorité sanitaire américaine encadre strictement la stérilisation via plusieurs réglementations :
21 CFR Part 820 – Quality System Regulation :
- Système qualité obligatoire pour fabricants dispositifs médicaux
- Validation des procédés de stérilisation (Process Validation)
- Contrôle des fournisseurs et sous-traitants
- Documentation et archivage (Device History Record)
FDA Guidance « Sterilization Process Validation » (mise à jour 2023) :
- Méthodologie de développement et validation des cycles
- Critères d’acceptation des tests biologiques
- Exigences pour stérilisation terminale vs aseptique
- Soumission dossiers 510(k) pour équipements
Standards AAMI (Association for the Advancement of Medical Instrumentation)
AAMI ST79:2017 – « Comprehensive Guide to Steam Sterilization » :
- Guide de référence pour stérilisation vapeur en établissements de santé
- Protocoles de validation détaillés (IQ/OQ/PQ)
- Critères de libération des charges
- Formation et compétences du personnel
AAMI ST8:2013 – Biological Indicators :
- Spécifications indicateurs biologiques
- Protocoles de tests de résistance
- Critères de validation des systèmes de lecture
🏥 EXEMPLE USA – JOHNS HOPKINS HOSPITAL (BALTIMORE)
• Conformité : FDA + Joint Commission + AAMI
• Validation : Annuelle obligatoire par organisme accrédité
• Coût : 180 000 USD/an pour 24 autoclaves
• Audit : Inspection Joint Commission tous les 3 ans
• Innovation : Système qualité intégré (Epic + STERIS)
USP (United States Pharmacopeia)
- USP <1229> : « Sterilization of Compendial Articles »
- USP <1211> : « Sterility Assurance »
- USP <71> : « Sterility Tests »
3.3 Réglementation Japon
JMHLW (Ministry of Health, Labour and Welfare)
Pharmaceutical Affairs Law (PAL) :
- Loi cadre régissant dispositifs médicaux et pharmaceutiques
- Notification obligatoire n°0301007 pour validation stérilisation
- Certification fabricants et importateurs
- Surveillance post-commercialisation
J-GMP (Japanese Good Manufacturing Practice) :
- Bonnes pratiques de fabrication spécifiques au Japon
- Validation des procédés critiques
- Système qualité pharmaceutique
- Formation et qualification du personnel
Japanese Pharmacopoeia (JP 18)
- Chapitre général stérilisation : Méthodes et critères
- Tests biologiques : Geobacillus stearothermophilus obligatoire
- Critères d’acceptation : F₀ ≥ 8 minutes standard
- Validation équipements : Protocoles IQ/OQ/PQ
PMDA (Pharmaceuticals and Medical Devices Agency)
- Inspection obligatoire : Certification tous les 3 ans
- Audit qualité : Système documentaire complet
- Formation : Certification nationale du personnel
- Innovation : Soutien recherche et développement
🏭 EXEMPLE JAPON – TERUMO CORPORATION (TOKYO)
• Statut : Leader mondial dispositifs médicaux
• Sites : 22 usines avec validation PMDA
• Innovation : R&D stérilisation (2% CA annuel)
• Export : 67 pays, reconnaissance mutuelle validations
• Qualité : Zéro défaut depuis 15 ans (Sigma 6)
3.4 Tableau Comparatif International
| Aspect | Europe (ISO/EN) | États-Unis (FDA) | Japon (JMHLW) |
|---|---|---|---|
| Norme principale | ISO 17665:2024 EN 285:2015 | FDA 21 CFR 820 AAMI ST79 | J-GMP JP 18 |
| F₀ minimum | ≥ 8 minutes | ≥ 12 minutes (pharma) ≥ 8 minutes (DM) | ≥ 8 minutes |
| Validation | IQ/OQ/PQ selon ISO | IQ/OQ/PQ + FDA 510(k) | IQ/OQ/PQ + PMDA |
| Requalification | Annuelle | Annuelle + post-maintenance | Tous les 3 ans |
| Test biologique | Geobacillus stearothermophilus | Geobacillus stearothermophilus | Geobacillus stearothermophilus |
| Traçabilité | UDI obligatoire (MDR) | UDI + 510(k) notification | Système national intégré |
| Inspection | Organismes notifiés | FDA + Joint Commission | PMDA |
| Sanctions | Retrait CE, amendes | Warning Letter, fermeture | Suspension licence |
3.5 Convergence et Divergences
Points de Convergence
- Microorganisme test : Geobacillus stearothermophilus universellement adopté
- Approche validation : IQ/OQ/PQ standardisée mondialement
- Système qualité : ISO 9001 base commune
- Formation : Exigences de compétences similaires
Divergences Persistantes
- F₀ pharmaceutique : 8 min (Europe/Japon) vs 12 min (USA)
- Fréquence requalification : Annuelle (Europe/USA) vs 3 ans (Japon)
- Approche réglementaire : Normative (Europe) vs Guideline (USA) vs Hybride (Japon)
- Coûts conformité : Variables selon juridiction
⚠️ ATTENTION RÉGLEMENTAIRE
Chaque juridiction impose ses propres exigences. Une validation conforme en Europe peut nécessiter des compléments pour acceptation FDA ou PMDA. Anticiper les exigences spécifiques dès la conception des procédés.
CHAPITRE 4 : VALIDATION DES PROCÉDÉS
4.1 Approche Systématique de Validation
La validation des procédés de stérilisation constitue le fondement de l’assurance qualité. Selon ISO 17665:2024, la validation se définit comme « la confirmation, par des preuves objectives, que les exigences pour une utilisation spécifique ont été remplies ».
Schéma complet du processus de validation d’autoclave
Les Trois Phases de Qualification
La validation suit une approche séquentielle en trois phases complémentaires :
- QI (Qualification d’Installation) : Vérification de la conformité d’installation
- QO (Qualification Opérationnelle) : Démonstration des performances techniques
- QP (Qualification de Performance) : Preuve de l’efficacité microbiologique
🎯 OBJECTIFS DE LA VALIDATION
• Sécurité : Garantir la stérilité des dispositifs médicaux
• Reproductibilité : Assurer la constance des résultats
• Conformité : Respecter les exigences réglementaires
• Traçabilité : Documenter toutes les étapes
4.2 Qualification d’Installation (QI/IQ)
Objectifs de la QI
La QI vise à vérifier la conformité de l’installation par rapport aux spécifications techniques et réglementaires :
Documentation à Vérifier
- ✓ Plans et schémas d’installation (conformité locaux)
- ✓ Spécifications techniques du fabricant
- ✓ Conformité aux normes électriques (NF C 15-100 en France)
- ✓ Conformité plomberie et évacuations
- ✓ Qualité de la vapeur d’alimentation (selon EN 285)
- ✓ Calibration des sondes et instruments de mesure (COFRAC)
- ✓ Formation initiale des opérateurs
- ✓ Procédures d’utilisation et de maintenance
Tests QI Obligatoires
1. Vérification alimentation vapeur :
| Paramètre | Spécification EN 285 | Méthode de test |
|---|---|---|
| Sécheresse vapeur | ≥ 0,97 (97%) | Test séparation/condensation |
| Gaz non-condensables | ≤ 3,5% vol. | Analyse chromatographique |
| Surchauffe | ≤ 25°C | Mesure température/pression |
| Pression alimentation | 3,5-6,0 bars | Manomètre calibré |
2. Tests de sécurité :
- Fonctionnement soupapes de sécurité (tarage)
- Verrouillages de porte (pression, température)
- Systèmes d’alarme (sonore, visuel)
- Arrêts d’urgence
🏥 EXEMPLE PRATIQUE – CHU GRENOBLE
« La QI de nos 6 autoclaves Steelco classe B (500L) a nécessité 3 semaines avec une équipe de 4 techniciens. Point critique : placement de 24 sondes PT100 calibrées COFRAC pour le mapping thermique initial. Coût total QI : 45 000€. »
4.3 Qualification Opérationnelle (QO/OQ)
Objectifs de la QO
La QO démontre que l’autoclave fonctionne selon ses spécifications dans toutes les conditions d’utilisation prévues.
Tests à Vide (Chambre Vide)
1. Test Bowie-Dick (Norme EN 867-5) :
- Objectif : Vérifier la pénétration de vapeur et détection fuites d’air
- Critère : Changement de couleur uniforme en < 3,5 minutes
- Fréquence : Quotidienne pour autoclaves classe B
- Placement : Centre géométrique de la chambre
2. Test d’étanchéité (Leak Test) :
- Procédure : Vide poussé (≤ 20 mbar) maintenu 5 minutes
- Critère classe B : Taux de fuite < 1,3 kPa/min
- Critère classe N : Taux de fuite < 2,5 kPa/min
Tests chimiques et biologiques pour validation
Tests en Charge
1. Mapping thermique avec charge de référence :
- Sondes : 9-12 thermocouples selon EN 285 (minimum 1 par 50L)
- Positionnement : Points stratégiques + centre géométrique
- Charge test