Blog
ATTESTER LES SOLUTIONS DE SURVEILLANCE DE LA STÉRILISATION :
UNE ANALYSE MONDIALE DES STANDARDS ET PRATIQUES
Introduction
Dans l’écosystème complexe des soins de santé modernes, la stérilisation des dispositifs médicaux ne constitue pas simplement une procédure logistique, mais la pierre angulaire de la sécurité des patients. Alors que les interventions chirurgicales deviennent de plus en plus invasives et que la résistance aux antimicrobiens menace les systèmes de santé mondiaux, la capacité à garantir qu’un instrument est exempt de toute forme de vie microbienne est critique.
Les infections associées aux soins (IAS) représentent un fardeau majeur de santé publique. Selon l’Organisation Mondiale de la Santé (OMS), des centaines de millions de patients sont affectés chaque année par des IAS, entraînant des décès évitables et des coûts financiers massifs pour les systèmes de santé. Une part significative de ces infections peut être attribuée à une stérilisation inadéquate ou à une rupture dans la chaîne de stérilité.
C’est dans ce contexte que la surveillance de la stérilisation prend tout son sens. Il ne suffit plus de soumettre un instrument à un cycle d’autoclave ; il est impératif d’attester, c’est-à-dire de prouver avec une certitude scientifique, que les paramètres létaux nécessaires à la destruction des micro-organismes ont été atteints et maintenus. Ce rapport de 4000 mots explore les méthodologies, les technologies et les cadres réglementaires qui définissent aujourd’hui la surveillance de la stérilisation à travers le monde, en mettant en lumière les disparités et les convergences entre les grandes puissances médicales que sont les États-Unis, l’Europe, la Chine, la Russie et l’Inde.
Section 1 : Comprendre les Solutions de Surveillance
La validation de la stérilité repose sur une triade de surveillance : physique, chimique et biologique. Chacune joue un rôle distinct mais complémentaire pour assurer le niveau d’assurance de stérilité (SAL – Sterility Assurance Level) de 10-6 requis pour les dispositifs critiques.
1.1 Indicateurs Biologiques (IB) : Le « Gold Standard »
Les indicateurs biologiques sont considérés comme la méthode de surveillance la plus critique car ils testent directement la létalité du processus en utilisant des spores bactériennes hautement résistantes. Pour la stérilisation à la vapeur, l’organisme de référence est Geobacillus stearothermophilus, tandis que pour l’oxyde d’éthylène (EtO) et la chaleur sèche, on utilise Bacillus atrophaeus.
L’évolution technologique a transformé les IB. Auparavant, l’incubation nécessitait jusqu’à 7 jours. Aujourd’hui, grâce à la détection par fluorescence enzymatique, des systèmes comme ceux de 3M ou STERIS permettent une lecture en 20 minutes à 3 heures, permettant aux hôpitaux de libérer les charges en toute confiance avant même qu’elles n’atteignent le bloc opératoire.
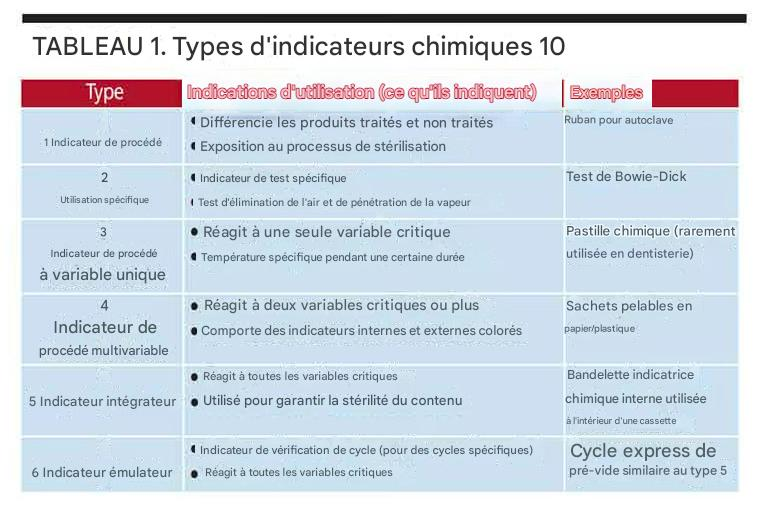
1.2 Indicateurs Chimiques (IC)
Régis par la norme ISO 11140, les indicateurs chimiques changent de couleur lorsqu’ils sont exposés à un ou plusieurs paramètres critiques (temps, température, présence de l’agent stérilisant). Ils sont classés en six types :
- Type 1 (Témoins de passage) : Indiquent simplement que l’article a été exposé au processus (ex: ruban adhésif sur les paquets).
- Type 4 (Multi-paramétriques) : Réagissent à deux paramètres ou plus.
- Type 5 (Intégrateurs) : Réagissent à tous les paramètres critiques et sont corrélés à la mort des spores biologiques.
- Type 6 (Émulateurs) : Conçus pour réagir à un cycle spécifique précis (ex: 134°C pendant 3,5 min).
1.3 Surveillance Physique et Numérique
La surveillance physique implique la vérification en temps réel des données du cycle via les capteurs du stérilisateur (température, pression, vide, temps). L’ère moderne a introduit l’IoT (Internet des Objets) dans ce domaine. Les systèmes de surveillance automatisés connectent désormais les autoclaves aux systèmes d’information hospitaliers (SIH), garantissant une traçabilité numérique inviolable où chaque cycle est enregistré, analysé et archivé sans intervention humaine, réduisant ainsi drastiquement le risque d’erreur.
Section 2 : Standards Internationaux et Paysage Réglementaire
Bien que l’objectif de stérilité soit universel, les chemins réglementaires pour y parvenir varient. L’harmonisation est en cours, principalement guidée par les normes ISO, mais des spécificités nationales demeurent.
Comparatif des Exigences Réglementaires
| Région / Pays | Organisme Régulateur | Standards Clés | Spécificités de Surveillance |
|---|---|---|---|
| États-Unis | FDA (Food and Drug Administration) | 21 CFR Part 820, AAMI ST79 | Exigence stricte de validation des équipements. Tests biologiques hebdomadaires minimum (recommandation CDC), préférentiellement quotidiens, et à chaque charge pour les implants. |
| Europe | Agences Nationales (ANSM, BfArM) sous MDR | EN ISO 17665, EN ISO 15883 | Focalisation intense sur la validation des procédés. Le marquage CE pour les dispositifs de surveillance est obligatoire sous le règlement MDR 2017/745. |
| Chine | NMPA (National Medical Products Administration) | GB 18278, WS 310 | Normes GB (Guobiao) souvent alignées sur l’ISO mais avec des exigences documentaires locales très lourdes. Surveillance stricte dans les hôpitaux de classe 3A. |
| Russie | Roszdravnadzor | GOST ISO 11607, GOST R 59092 | Système GOST historique intégrant progressivement les normes ISO. Exigences spécifiques pour les équipements fabriqués localement. |
| Inde | CDSCO, NABH | NABH Guidelines, Indian Pharmacopoeia | Directives NABH pour les CSSD (Central Sterile Supply Departments). Transition d’une surveillance manuelle vers des standards automatisés dans les grands groupes privés. |
Section 3 : États-Unis – Leader en Innovation et Standardisation
Les États-Unis dominent le marché mondial de la surveillance de la stérilisation, estimé à 834,2 millions de dollars en 2025 et projeté vers 1,16 milliard d’ici 2032. Cette prééminence s’explique par une culture du litige médical qui pousse les établissements à adopter les technologies de « Preuve de Stérilité » les plus avancées pour se prémunir contre les poursuites.
Technologies Dominantes et Acteurs Clés
Le marché américain est le berceau de géants comme 3M (désormais Solventum pour la branche santé), STERIS et ASP (Advanced Sterilization Products).
3M Attest™ : La Vitesse comme Norme
Le système 3M Attest Rapid Readout a révolutionné les pratiques américaines. Dans des institutions prestigieuses comme la Mayo Clinic ou la Cleveland Clinic, l’attente de 24 à 48 heures pour un résultat biologique est révolue. Les incubateurs à lecture rapide permettent de valider des cycles vapeur en moins d’une heure. Cela permet une rotation rapide des instruments coûteux (comme les endoscopes ou les robots Da Vinci) tout en maintenant un niveau de sécurité maximal.

STERIS et ASP : L’Intégration Totale
Au Johns Hopkins Hospital, l’utilisation des indicateurs autonomes STERIS VERIFY V24 illustre la tendance à l’intégration. Ces indicateurs sont conçus pour fonctionner en synergie avec les stérilisateurs de la marque, envoyant directement les résultats négatifs ou positifs au logiciel de traçabilité de l’hôpital. De même, la technologie STERRAD VELOCITY d’ASP, utilisée dans plus de 5 000 hôpitaux américains, intègre la surveillance biologique directement dans le processus de stérilisation au peroxyde d’hydrogène (VH2O2), crucial pour les instruments thermosensibles.
Les directives du CDC (Centers for Disease Control and Prevention) imposent un rythme soutenu : test biologique hebdomadaire obligatoire pour chaque stérilisateur, et quotidien recommandé, avec une exigence absolue de tester chaque charge contenant un implant et d’attendre le résultat avant utilisation.
Section 4 : Europe – L’Excellence par la Standardisation Rigoureuse
En Europe, l’approche est moins axée sur la vitesse de rotation que sur la validation exhaustive du procédé. L’Allemagne, la France et le Royaume-Uni mènent la charge avec des infrastructures de stérilisation centralisées (CSSD) hautement industrialisées.
Allemagne : L’Ingénierie de Précision
L’Allemagne, siège de leaders comme MMM Group, applique strictement la norme DIN EN ISO 17665. À l’hôpital universitaire de la Charité à Berlin, l’un des plus grands d’Europe, la surveillance ne se limite pas aux indicateurs. Elle englobe un monitoring digital complet où chaque paramètre physique du cycle est comparé en temps réel à une courbe de référence validée. Getinge, géant suédo-allemand, y déploie des systèmes T-DOC qui tracent chaque instrument individuel du patient à la stérilisation et inversement.
France : La Traçabilité au Cœur du Système
En France, la réglementation impose une traçabilité « à l’instrument » ou « au sachet ». L’Assistance Publique – Hôpitaux de Paris (AP-HP) utilise des solutions centralisées intégrant les autoclaves de fabricants comme Belimed ou CISA. La Société Française de Stérilisation (SF2S) édite des guides de bonnes pratiques qui vont souvent au-delà des normes européennes. L’accent est mis sur les dispositifs d’épreuve de procédé (PCD) qui simulent les conditions les plus difficiles à stériliser (corps creux) au sein de la charge.
Royaume-Uni : L’Héritage du NHS
Le NHS (National Health Service) dispose de directives techniques (HTM – Health Technical Memoranda) très prescriptives. Les grands « NHS Trusts » ont souvent externalisé leurs unités de stérilisation à des « Super Centres » industriels qui traitent les instruments pour plusieurs hôpitaux. Dans ces usines de stérilisation, la surveillance est statistique et industrielle, utilisant des indicateurs chimiques de type 6 (émulateurs) pour chaque paquet, garantissant que les conditions critiques ont été atteintes à l’intérieur même des sets chirurgicaux.
Section 5 : Chine – Une Expansion Rapide et Réglementée
Le marché chinois de la stérilisation connaît une croissance fulgurante, portée par la modernisation massive des infrastructures de santé et les réformes de la NMPA (National Medical Products Administration). Le marché devrait atteindre près de 790 millions de dollars dans les prochaines années.
La Hiérarchie Hospitalière et la Stérilisation
En Chine, la qualité des soins est stratifiée. Les hôpitaux de Grade 3A (三甲医院), comme le Peking Union Medical College Hospital à Pékin ou le Shanghai General Hospital, sont équipés de technologies de pointe rivalisant avec l’Occident. Dans ces établissements, l’utilisation de systèmes de surveillance importés (3M, STERIS) est courante. La réglementation chinoise impose la création de centres de stérilisation centralisés (CSSD) obligatoires, remplaçant les petites unités dispersées dans les départements, ce qui permet un meilleur contrôle qualité.
Réglementations Spécifiques et Acteurs Locaux
La norme WS 310 (parties 1, 2 et 3) régit le nettoyage, la désinfection et la stérilisation. Elle exige une surveillance physique, chimique et biologique rigoureuse. Contrairement à l’Europe qui privilégie parfois la surveillance paramétrique, la Chine reste très attachée aux contrôles tangibles (indicateurs chimiques dans chaque paquet, biologiques quotidiens). Si les marques internationales dominent le haut de gamme, des acteurs locaux comme Shinva Medical Instrument montent en puissance, proposant des solutions de surveillance intégrées validées par la NMPA et conformes aux standards GB.
Section 6 : Russie – Entre Standards GOST et Modernisation
La Russie présente un paysage unique où les normes historiques GOST (Gosudarstvenny Standart) coexistent avec une adoption progressive des standards ISO internationaux. L’agence fédérale Roszdravnadzor supervise la conformité des dispositifs médicaux.
Technologies Spécifiques et Cadre GOST
Le standard GOST R 59092-2020 définit les méthodes de test pour les indicateurs biologiques et chimiques. Une particularité du marché russe est la prévalence de solutions adaptées aux contraintes logistiques du vaste territoire. Des entreprises comme Med TeCo ont développé des stérilisateurs plasma-peroxyde locaux (série Plaster) pour répondre aux besoins de stérilisation à basse température sans dépendre entièrement des importations occidentales.
Dans les grands centres fédéraux de Moscou et Saint-Pétersbourg, les protocoles de surveillance s’alignent sur les standards européens. Cependant, le défi majeur reste l’harmonisation des pratiques dans les régions éloignées, où la modernisation des infrastructures hospitalières est un chantier permanent. L’utilisation d’indicateurs chimiques multi-paramétriques (Classe 4 ou 5) devient la norme exigée pour remplacer les indicateurs de processus simples (Classe 1) utilisés par le passé.
Section 7 : Inde – Vers une Accréditation Globale
L’Inde, avec son secteur de la santé privé en plein essor et son tourisme médical, met l’accent sur l’accréditation internationale pour attirer les patients. Le NABH (National Accreditation Board for Hospitals & Healthcare Providers) joue un rôle crucial en définissant des directives strictes pour les départements de stérilisation (CSSD).
L’Exemple des Géants Hospitaliers
Des institutions phares comme l’AIIMS (All India Institute of Medical Sciences) à New Delhi servent de modèles nationaux. Leurs départements de stérilisation suivent des protocoles de contrôle des infections (IPC) rigoureux, incluant des audits réguliers et une surveillance biologique systématique. Le groupe Apollo Hospitals, pionnier dans le secteur privé, a mis en place un programme de contrôle des infections dès 2010 qui rivalise avec les standards américains, intégrant la surveillance de la qualité de l’eau, de l’air et la stérilité des instruments.
Défis et Opportunités
Le marché indien de la stérilisation est en pleine expansion, tiré par l’augmentation du volume chirurgical. Le défi principal demeure la formation du personnel technique et la mise à niveau des équipements dans les zones rurales. On observe une adoption croissante des technologies de stérilisation basse température (plasma) pour traiter les endoscopes et instruments complexes, nécessitant des indicateurs biologiques spécifiques que fournissent majoritairement des acteurs internationaux comme 3M ou Getinge.
Section 8 : Technologies Émergentes et Futur de la Surveillance
L’avenir de la surveillance de la stérilisation ne réside plus seulement dans la chimie ou la biologie, mais dans la donnée.
- Intelligence Artificielle (IA) et IoT : Les nouveaux stérilisateurs « intelligents » sont capables de prédire les échecs de cycle avant qu’ils ne surviennent en analysant les micro-variations de pression ou de température, alertant les techniciens en temps réel.
- Traçabilité Blockchain : Pour garantir l’intégrité des données, certaines solutions expérimentales utilisent la blockchain pour créer un registre immuable de chaque cycle de stérilisation, rendant impossible la falsification des preuves de stérilité en cas de litige.
- Capteurs Électroniques Autonomes : Des « dataloggers » sans fil de la taille d’une pièce de monnaie peuvent désormais être placés au cœur des charges chirurgicales, mesurant température et pression in situ avec une précision supérieure aux sondes externes.
- Automatisation Robotique : Le chargement et le déchargement robotisés des autoclaves, couplés à une lecture automatisée des indicateurs biologiques, éliminent le facteur d’erreur humaine, cause principale des échecs de stérilisation.
Conclusion
Attester la stérilisation est passé d’une simple vérification procédurale à une science des données complexe et critique. Que ce soit aux États-Unis avec leur quête de rapidité, en Europe avec leur rigueur de validation, ou dans les marchés émergents comme la Chine et l’Inde qui modernisent leurs standards à marche forcée, la tendance est claire : la convergence vers une sécurité absolue.
Les solutions de surveillance ne sont plus des consommables accessoires, mais des composants vitaux de l’infrastructure de santé. À mesure que les technologies évoluent vers plus de connectivité et d’intelligence, la promesse d’une chirurgie sans infection devient de plus en plus tangible, protégeant la vie des patients aux quatre coins du globe.
