Blog
LES AUTOCLAVES INDUSTRIELS : FONCTIONNEMENT, APPLICATIONS ET AVANTAGES
1. INTRODUCTION
Les autoclaves industriels représentent l’une des technologies les plus cruciales dans le domaine de la stérilisation moderne. Ces équipements sophistiqués utilisent la vapeur d’eau sous pression pour éliminer tous les micro-organismes vivants, incluant les bactéries, virus, champignons et leurs spores, garantissant ainsi un niveau de stérilité conforme aux exigences les plus strictes des industries pharmaceutique, alimentaire et médicale.
L’importance des autoclaves industriels dans l’économie moderne ne peut être sous-estimée. Ils sont essentiels pour assurer la sécurité des produits pharmaceutiques, la salubrité des aliments transformés et la stérilité des dispositifs médicaux. Selon les estimations de l’Organisation Mondiale de la Santé (OMS), les infections nosocomiales affectent des millions de patients chaque année, rendant la stérilisation efficace absolument critique pour la santé publique.
L’histoire des autoclaves remonte au XIXe siècle avec les travaux pionniers de Charles Chamberland et Louis Pasteur. En 1879, Chamberland développe le premier autoclave à vapeur, révolutionnant les pratiques de stérilisation. Cette invention marque le début d’une ère nouvelle dans la microbiologie et la médecine préventive. Les premiers modèles utilisaient des températures de 115°C à 120°C pendant des durées prolongées.
L’évolution technologique des autoclaves industriels s’est accélérée au cours du XXe siècle. Les années 1950 voient l’introduction des premiers systèmes de pré-vide, permettant une meilleure pénétration de la vapeur dans les matériaux poreux. Les années 1970 marquent l’avènement des contrôles électroniques et des premiers systèmes de monitoring automatisé. Les années 1990 introduisent les technologies de validation en temps réel et les systèmes de traçabilité informatisés.
Aujourd’hui, les autoclaves industriels intègrent des technologies de pointe : systèmes de contrôle par automates programmables (PLC), interfaces homme-machine (HMI) tactiles, capteurs de haute précision, systèmes de monitoring en temps réel, validation automatique des cycles et connectivité réseau pour la supervision à distance. Ces avancées permettent d’atteindre des niveaux de fiabilité et de reproductibilité inégalés.
Les enjeux de la stérilisation industrielle moderne sont multiples et complexes. La mondialisation des échanges commerciaux impose des standards de qualité harmonisés au niveau international. Les réglementations deviennent de plus en plus strictes, exigeant une documentation exhaustive et une traçabilité complète des processus de stérilisation. Les normes ISO 17665, EN 285 et les pharmacopées internationales définissent des exigences précises en termes de validation, de monitoring et de maintenance.
La pression économique pousse les industriels vers une optimisation constante des processus. Les autoclaves modernes doivent offrir une efficacité énergétique maximale, des temps de cycle réduits et une maintenance préventive optimisée. L’intégration dans les systèmes de production automatisés devient une exigence incontournable pour maintenir la compétitivité.
Les défis environnementaux imposent également de nouvelles contraintes. La réduction de la consommation d’eau, la récupération de la chaleur des condensats et l’optimisation des cycles de nettoyage deviennent des priorités. Les technologies de vapeur propre et les systèmes de traitement des effluents se développent rapidement pour répondre à ces enjeux.
Enfin, l’évolution des matériaux et des produits à stériliser pose de nouveaux défis techniques. Les biomatériaux, les dispositifs médicaux implantables, les thérapies géniques et cellulaires nécessitent des protocoles de stérilisation spécifiques et des validations adaptées. Les autoclaves industriels doivent s’adapter à cette diversité croissante tout en maintenant leur efficacité et leur fiabilité.
2. PRINCIPES SCIENTIFIQUES DE LA STÉRILISATION
La stérilisation par vapeur d’eau repose sur des principes thermodynamiques et microbiologiques fondamentaux qui gouvernent l’efficacité et la fiabilité du processus. La compréhension approfondie de ces mécanismes est essentielle pour concevoir, valider et optimiser les cycles de stérilisation industriels.
2.1 Thermodynamique de la vapeur saturée
La vapeur saturée constitue l’agent stérilisant idéal en raison de ses propriétés thermodynamiques exceptionnelles. À la pression atmosphérique, l’eau bout à 100°C, mais sous pression, la température d’ébullition augmente selon la relation de Clausius-Clapeyron. Cette relation permet d’atteindre des températures stérilisantes efficaces tout en maintenant la vapeur à l’état saturé.
Propriétés thermodynamiques de la vapeur saturée :
- À 121°C : Pression absolue de 2,03 bar (1,03 bar manométrique)
- À 134°C : Pression absolue de 3,04 bar (2,04 bar manométrique)
- Chaleur latente de vaporisation : 2257 kJ/kg à 100°C
- Coefficient de transfert thermique : 10 000 à 100 000 W/m²·K
La condensation de la vapeur sur les surfaces froides libère instantanément sa chaleur latente, créant un transfert thermique extrêmement efficace. Ce phénomène explique pourquoi la vapeur saturée est plus efficace que l’air chaud sec pour la stérilisation. La pénétration de la vapeur dans les matériaux poreux et les espaces confinés est facilitée par la différence de pression et l’affinité de l’eau pour la plupart des matériaux organiques.
L’élimination complète de l’air est cruciale pour l’efficacité de la stérilisation. L’air résiduel forme des poches isolantes qui empêchent le contact direct entre la vapeur et les surfaces à stériliser. Les autoclaves modernes utilisent différentes méthodes d’évacuation de l’air : gravité (pour les charges liquides), pré-vide (pour les charges poreuses) et pulsations vapeur-vide (pour les charges complexes).
2.2 Cinétique de destruction microbienne
La destruction des micro-organismes par la chaleur suit une cinétique de premier ordre, décrite par l’équation de Chick : log N = log N₀ – t/D, où N représente le nombre de micro-organismes survivants au temps t, N₀ le nombre initial, et D la valeur D (temps de réduction décimale). Cette relation logarithmique implique qu’il n’existe jamais de stérilité absolue, mais seulement une probabilité de stérilité.
Valeurs D typiques à 121°C :
- Bacillus subtilis (forme végétative) : 0,5-1 minute
- Clostridium botulinum (spores) : 0,1-0,2 minute
- Geobacillus stearothermophilus (spores) : 1,5-2,5 minutes
- Prions : > 60 minutes (résistance exceptionnelle)
La valeur z représente l’augmentation de température nécessaire pour diviser la valeur D par 10. Pour la plupart des spores bactériennes, z = 10°C, ce qui signifie qu’une augmentation de 10°C de la température de stérilisation divise par 10 le temps nécessaire pour obtenir la même réduction microbienne. Cette relation permet d’optimiser les cycles en fonction des contraintes thermiques des produits à stériliser.
Le concept de stérilité commerciale, largement utilisé dans l’industrie alimentaire, accepte un niveau de réduction microbienne de 12 log (99,9999999999% de destruction) pour Clostridium botulinum. En milieu pharmaceutique et médical, les exigences peuvent atteindre 17 log de réduction pour certaines applications critiques.
2.3 Mécanismes d’action à 121°C et 134°C
Les températures de référence 121°C et 134°C correspondent à des optimums d’efficacité pour différents types d’applications. À 121°C, la dénaturation des protéines et la coagulation des constituants cellulaires s’effectuent à une vitesse compatible avec la préservation de la plupart des matériaux thermosensibles. Cette température est standard pour la stérilisation des milieux de culture, des solutions parentérales et des dispositifs médicaux réutilisables.
La température de 134°C, plus agressive, permet des cycles courts particulièrement adaptés à la stérilisation rapide des instruments chirurgicaux. L’augmentation de 13°C par rapport à 121°C réduit le temps de stérilisation d’un facteur 20 environ, permettant des cycles de 3-4 minutes au lieu de 15-20 minutes. Cette réduction drastique du temps d’exposition thermique minimise la dégradation des matériaux sensibles tout en maintenant l’efficacité stérilisante.
Mécanismes moléculaires de destruction : La vapeur saturée provoque la dénaturation irréversible des protéines essentielles, la disruption des membranes cellulaires par osmose, l’hydrolyse des liaisons peptidiques et la coagulation des acides nucléiques. Ces mécanismes multiples expliquent l’efficacité universelle de la stérilisation vapeur contre tous les types de micro-organismes.
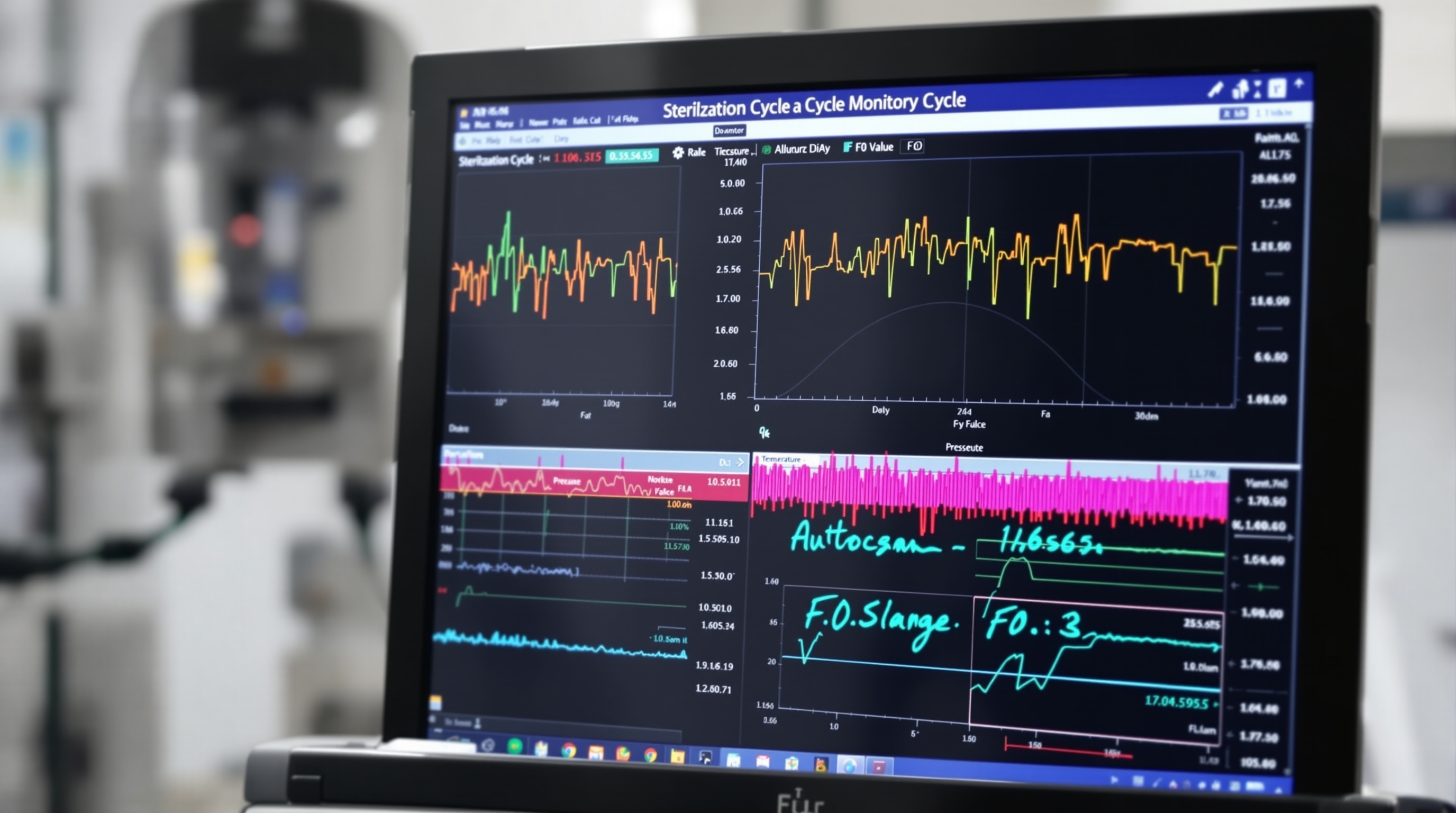
2.4 Facteurs F₀ et validation stérilisation
Le facteur F₀ (F-zéro) constitue l’outil mathématique fondamental pour quantifier l’efficacité léthale d’un cycle de stérilisation. Il représente le temps équivalent de traitement à 121°C qui produirait le même effet létal que le cycle réel, en tenant compte des variations de température durant tout le processus. Le calcul s’effectue selon la formule : F₀ = ∫ 10^((T-121)/z) dt, où T est la température instantanée et z la valeur z de référence (10°C pour les spores).
La valeur F₀ minimale requise varie selon l’application : F₀ = 8 minutes pour les dispositifs médicaux non implantables, F₀ = 12 minutes pour les dispositifs implantables, F₀ = 15 minutes pour les produits pharmaceutiques stériles. Ces valeurs correspondent à des niveaux d’assurance stérilité (SAL) de 10⁻⁶ à 10⁻⁸.
Le calcul du F₀ en temps réel permet l’optimisation automatique des cycles. Les systèmes modernes ajustent la durée du palier de stérilisation en fonction de la cinétique réelle de montée en température, compensant les variations de charge, de configuration ou de performance de l’autoclave. Cette approche garantit une efficacité constante tout en minimisant la sur-stérilisation.
La validation physique, chimique et biologique des cycles de stérilisation s’appuie sur ces concepts théoriques. Les indicateurs biologiques contenant des spores de Geobacillus stearothermophilus, micro-organisme de référence pour sa résistance thermique, permettent de vérifier expérimentalement l’atteinte des niveaux de stérilité requis. La corrélation entre les valeurs F₀ calculées et la destruction des indicateurs biologiques valide la fiabilité du processus.
L’intégration de capteurs de température multiples dans la charge permet une cartographie thermique tridimensionnelle et le calcul de valeurs F₀ localisées. Cette approche révèle les zones difficiles à stériliser (cold spots) et guide l’optimisation du chargement et des paramètres de cycle. Les algorithmes d’intelligence artificielle commencent à être utilisés pour prédire et corriger automatiquement les hétérogénéités thermiques.
3. TECHNOLOGIES D’AUTOCLAVES INDUSTRIELS
L’évolution technologique des autoclaves industriels a conduit au développement de systèmes sophistiqués adaptés aux exigences spécifiques de chaque secteur d’application. Les technologies modernes intègrent des innovations en matière de génération et de distribution de vapeur, d’évacuation de l’air, de contrôle des paramètres et d’automatisation des processus.
3.1 Autoclaves à pré-vide (technologie avancée)
Les autoclaves à pré-vide représentent l’état de l’art technologique pour la stérilisation des charges poreuses et des instruments complexes. Cette technologie utilise une pompe à vide puissante pour évacuer l’air de l’enceinte avant l’introduction de la vapeur, garantissant une pénétration optimale dans tous les espaces confinés et matériaux poreux.
Le cycle débute par une phase de conditionnement comprenant plusieurs pulsations vide-vapeur. Chaque pulsation évacue l’air résiduel plus efficacement qu’un simple tirage au vide statique. Typiquement, 3 à 4 pulsations permettent d’atteindre un niveau de vide de 20-50 mbar absolu, éliminant plus de 99% de l’air initial. Cette évacuation poussée est particulièrement critique pour les textiles, les emballages poreux et les instruments à lumière creuse.
Paramètres typiques des autoclaves à pré-vide :
- Niveau de vide : 20-50 mbar absolu
- Nombre de pulsations : 3-4 minimum
- Débit de pompe : 50-200 m³/h selon volume enceinte
- Temps de conditionnement : 8-15 minutes
- Vitesse de montée en pression : 50-100 mbar/minute
La phase de stérilisation s’effectue dans des conditions parfaitement maîtrisées. L’absence d’air résiduel garantit une température homogène dans tout le volume de l’enceinte. Les gradients thermiques sont minimisés, permettant des temps de cycle plus courts et une meilleure reproductibilité. La régulation de pression s’effectue par modulation de l’injection de vapeur et du fonctionnement de la pompe à vide.
Le séchage des charges constitue un avantage majeur des autoclaves à pré-vide. En fin de cycle, l’évacuation de la vapeur par pompage crée des conditions d’évaporation intense qui éliminent rapidement l’humidité résiduelle. Le séchage peut être complété par injection d’air stérile filtré ou par chauffage des parois de l’enceinte. Cette capacité de séchage est essentielle pour les textiles, les emballages papier et les instruments destinés au stockage stérile.
Les systèmes de pompage modernes utilisent des pompes à anneau liquide, à palettes ou à vis selon les exigences spécifiques. Les pompes à anneau liquide, bien qu’énergivores, offrent une excellente résistance à la vapeur et aux condensats. Les pompes à palettes sèches, plus efficaces énergétiquement, nécessitent des systèmes de protection contre la condensation. Les pompes à vis combinent efficacité et robustesse mais représentent un investissement plus important.
3.2 Systèmes gravitaires (applications spécifiques)
Les autoclaves gravitaires, plus simples technologiquement, restent largement utilisés pour des applications spécifiques où leur fonctionnement est parfaitement adapté. Le principe repose sur la différence de densité entre l’air froid (plus dense) et la vapeur chaude (moins dense) pour créer un écoulement naturel d’évacuation de l’air par le bas de l’enceinte.
Cette technologie excelle pour la stérilisation des liquides en récipients ouverts ou fermés. L’évacuation progressive de l’air par gravité évite les phénomènes de bouillonnement violent qui pourraient provoquer des débordements ou des bris de contenants. La montée en température graduelle permet l’expansion thermique contrôlée des liquides et l’équilibrage des pressions dans les contenants fermés.
Applications optimales des autoclaves gravitaires :
- Milieux de culture et solutions nutritives
- Solutions pharmaceutiques en grand volume
- Déchets liquides contaminés
- Verrerie de laboratoire non emballée
- Charges métalliques massives
La conception des autoclaves gravitaires privilégie la simplicité et la robustesse. L’injection de vapeur s’effectue généralement par le haut de l’enceinte, créant un écoulement descendant qui pousse l’air vers l’évacuation située en partie basse. Des chicanes internes guident l’écoulement et homogénéisent la distribution thermique. Le système de drainage condensats intègre un purgeur thermodynamique qui évacue automatiquement l’eau de condensation tout en retenant la vapeur.
Le contrôle des autoclaves gravitaires s’appuie sur des régulations de température et de pression relativement simples. La mesure de température s’effectue en plusieurs points stratégiques : sonde de régulation dans l’évacuation d’air (point le plus froid), sondes de sécurité dans l’enceinte et sondes de monitoring dans la charge. Cette configuration garantit que la stérilisation n’est validée qu’après l’atteinte de la température cible au point le plus défavorable.
Les performances énergétiques des autoclaves gravitaires sont généralement meilleures que celles des systèmes à pré-vide, en raison de l’absence de pompage. La consommation de vapeur est optimisée par des systèmes de récupération des condensats et de pré-chauffage des charges. L’isolation thermique renforcée et la récupération de chaleur sur les évents permettent d’atteindre des rendements énergétiques élevés.
3.3 Vapeur flash et cycles optimisés
La technologie vapeur flash révolutionne la stérilisation rapide d’instruments chirurgicaux et de dispositifs thermoresistants. Ce procédé utilise de la vapeur surchauffée à très haute température (jusqu’à 270°C) pour des temps d’exposition extrêmement courts (30 secondes à 4 minutes), permettant une stérilisation efficace sans dégradation des matériaux sensibles.
Le principe repose sur la détente brutale d’eau pressurisée (jusqu’à 40 bar) qui se vaporise instantanément en libérant une quantité massive d’énergie thermique. Cette vapeur flash, à température très élevée mais durée très courte, dénature rapidement les protéines microbiennes sans altérer significativement les matériaux de l’instrumentation. La cinétique de destruction microbienne, proportionnelle à l’exponentielle de la température, est considérablement accélérée.
Avantages de la vapeur flash : Cycles de 4-10 minutes contre 30-60 minutes en conventionnel, préservation des tranchants d’instruments, économie d’énergie, rotation rapide des instruments, adaptation aux urgences chirurgicales.
Les générateurs de vapeur flash intègrent des technologies de pointe : échangeurs thermiques à haute efficacité, systèmes de régulation ultra-rapides, capteurs de débit massique, analyseurs de qualité vapeur en temps réel. La production de vapeur flash nécessite une eau de qualité pharmaceutique (conductivité < 5 µS/cm) pour éviter les dépôts et la corrosion des surfaces chaudes.
L’optimisation des cycles combine différentes stratégies : profils de température variables selon la charge, adaptation automatique des paramètres en fonction de la masse thermique détectée, pré-conditionnement par vide pulsé pour les charges complexes, séchage optimisé par vide final et air stérile. Ces optimisations permettent de réduire les temps de cycle de 30 à 50% tout en maintenant l’efficacité stérilisante.
Les cycles personnalisés représentent l’avenir de la stérilisation industrielle. Des algorithmes d’intelligence artificielle analysent les données historiques de température, pression et F₀ pour identifier les paramètres optimaux de chaque type de charge. L’apprentissage automatique permet d’améliorer continuellement les performances en s’adaptant aux variations de l’environnement, de la charge et du vieillissement de l’équipement.
3.4 Contrôles PLC et automatisation
L’automatisation des autoclaves industriels s’appuie sur des automates programmables industriels (PLC) de haute performance qui orchestrent l’ensemble des fonctions de l’équipement. Ces systèmes intègrent des processeurs multicœurs, des mémoires étendues et des interfaces de communication industrielles standard (Profibus, Ethernet/IP, Modbus) permettant l’intégration dans les systèmes de supervision d’usine.
L’architecture de contrôle privilégie la redondance et la sécurité fonctionnelle. Les fonctions critiques (température, pression, niveau) sont doublées par des chaînes de mesure indépendantes reliées à des modules de sécurité certifiés SIL 2 ou SIL 3. Les algorithmes de régulation utilisent des correcteurs PID adaptatifs qui s’ajustent automatiquement aux variations de comportement dynamique de l’installation.
Fonctionnalités des systèmes PLC modernes :
- Gestion de 50-200 entrées/sorties selon complexité
- Temps de cycle programme : 1-10 ms
- Mémoire programme : 1-10 MB
- Interfaces communication : Ethernet, Profibus, Modbus
- Modules sécurité intégrés SIL 2/3
L’interface homme-machine (HMI) utilise des écrans tactiles industriels haute résolution (15-21 pouces) avec interface graphique intuitive. L’opérateur visualise en temps réel l’état de tous les paramètres process, les tendances historiques, les alarmes actives et l’avancement des cycles. La programmation des recettes s’effectue par menus déroulants sécurisés avec contrôle d’accès par codes ou badges. L’historisation des données couvre plusieurs années avec compression automatique et sauvegarde sur serveurs redondants.
La validation automatique des cycles élimine les erreurs humaines et garantit la conformité réglementaire. Le système compare continuellement les paramètres mesurés aux limites programmées, calcule les valeurs F₀ en temps réel et génère automatiquement les certificats de stérilisation. Toute dérive par rapport aux spécifications déclenche des alarmes et peut provoquer l’arrêt automatique du cycle selon les criticités définies.
L’intégration dans les systèmes d’information d’entreprise (ERP, LIMS, MES) s’effectue par interfaces standardisées. Les données de production (numéros de lots, températures, durées, résultats de validation) sont automatiquement transmises aux bases de données de traçabilité. Cette intégration permet la corrélation entre les paramètres de stérilisation et les résultats de contrôle qualité, facilitant les analyses statistiques et l’amélioration continue des processus.
4. FONCTIONNEMENT TECHNIQUE DÉTAILLÉ
Le fonctionnement des autoclaves industriels s’articule autour de cycles complexes parfaitement orchestrés pour garantir une stérilisation efficace et reproductible. La maîtrise de chaque phase du cycle et la compréhension des paramètres critiques sont essentielles pour optimiser les performances et assurer la conformité réglementaire.
4.1 Cycles de stérilisation complets
Un cycle de stérilisation complet comprend typiquement six phases distinctes : conditionnement, montée en température, stérilisation, évacuation, séchage et refroidissement. Chaque phase répond à des objectifs spécifiques et fait l’objet d’un contrôle rigoureux des paramètres physiques.
La phase de conditionnement prépare la charge et l’enceinte aux conditions de stérilisation. Pour les autoclaves à pré-vide, cette phase comprend les pulsations vide-vapeur qui éliminent l’air résiduel. Le nombre et l’amplitude des pulsations sont adaptés au type de charge : 3 pulsations pour les instruments métalliques, 4-5 pulsations pour les textiles et emballages poreux. Chaque pulsation atteint un niveau de vide de 70-100 mbar, suivi d’une injection de vapeur à 0,5-1 bar manométrique.
La montée en température s’effectue selon un profil contrôlé qui évite les chocs thermiques. La vitesse de montée est adaptée à la masse thermique de la charge : 2-5°C/minute pour les charges lourdes, 5-10°C/minute pour les instruments légers. Des sondes multiples surveillent l’homogénéité thermique et ajustent l’injection de vapeur pour minimiser les gradients. Le seuil de démarrage de la phase de stérilisation n’est franchi que lorsque tous les points de mesure atteignent la température cible ±1°C.
Paramètres typiques des phases de cycle :
| Phase | Durée | Température | Pression | Paramètres clés |
|---|---|---|---|---|
| Conditionnement | 5-15 min | Ambiante-80°C | 50-1000 mbar | Évacuation air |
| Montée température | 10-30 min | 80-121/134°C | 1-3 bar | Gradients thermiques |
| Stérilisation | 3-60 min | 121/134°C ±1°C | 2-3 bar ±0,1 | F₀ > seuil |
| Évacuation | 2-10 min | 121/134-80°C | 3-0,2 bar | Décompression |
| Séchage | 5-30 min | 80-40°C | 50-200 mbar | Humidité résiduelle |
| Refroidissement | 10-60 min | 40-25°C | Atmosphérique | Manipulation sûre |
La phase de stérilisation constitue le cœur du processus. La température et la pression sont maintenues dans des tolérances strictes (±1°C, ±0,1 bar) par des régulations haute performance. Le calcul du F₀ s’effectue en temps réel par intégration numérique avec échantillonnage à haute fréquence (1-10 secondes). La durée de la phase s’adapte automatiquement pour atteindre la valeur F₀ cible, compensant les variations de montée en température ou les perturbations transitoires.
L’évacuation de la vapeur s’effectue selon des profils contrôlés pour éviter l’ébullition brutale des liquides et minimiser la formation d’aérosols. La vitesse de décompression est limitée à 50-200 mbar/minute selon la nature de la charge. Des systèmes de refroidissement par pulvérisation d’eau ou circulation d’air accélèrent le retour à des températures de manipulation sûres.
4.2 Paramètres température/pression/temps
La maîtrise des paramètres température, pression et temps constitue le fondement de l’efficacité et de la reproductibilité de la stérilisation. Ces trois paramètres sont intimement liés par les lois de la thermodynamique et leur contrôle simultané nécessite des systèmes de régulation sophistiqués.
La mesure de température s’effectue par sondes de résistance platine Pt100 ou thermocouples type T, calibrées et certifiées selon les normes métrologiques. La précision requise est de ±0,5°C sur toute la gamme de fonctionnement, avec une dérive maximale de 0,1°C/an. Les sondes sont positionnées stratégiquement : point de régulation dans l’évacuation d’air (point froid), sondes de sécurité dans l’enceinte, sondes de monitoring dans la charge. La redondance des mesures permet la détection de défaillances et la continuité de service.
La régulation de température utilise des algorithmes PID (Proportionnel-Intégral-Dérivé) auto-adaptatifs qui s’ajustent aux caractéristiques dynamiques de l’installation. Les paramètres Kp (gain proportionnel), Ti (temps intégral) et Td (temps dérivé) sont optimisés automatiquement par des techniques d’identification en boucle fermée. Cette adaptation compense le vieillissement des composants, les encrassements et les variations de charge.
Précision des mesures critiques : Température ±0,5°C, Pression ±50 mbar, Temps ±1 seconde. Ces tolérances garantissent une reproductibilité suffisante pour les calculs de validation et la conformité réglementaire.
La mesure de pression fait appel à des transmetteurs piézorésistifs ou capacitifs étanchés haute température. La précision typique est de ±0,1% de l’étendue de mesure avec une stabilité long terme de ±0,05%/an. La compensation automatique des effets de température sur les capteurs évite les dérives lors des cycles thermiques. Les signaux sont transmis en 4-20 mA ou bus de terrain pour assurer l’immunité aux perturbations électromagnétiques.
La corrélation température-pression de la vapeur saturée fait l’objet d’une surveillance continue. Tout écart significatif (>50 mbar) entre la pression mesurée et la pression théorique correspondant à la température indique la présence d’incondensables (air résiduel) ou de surchauffe de vapeur. Ces détections déclenchent des alarmes et peuvent provoquer l’arrêt du cycle selon les seuils programmés.
La synchronisation temporelle s’appuie sur des horloges temps réel haute précision synchronisées sur des références externes (GPS, serveurs de temps réseau). L’horodatage des événements critiques (début/fin de phases, dépassements de seuils, alarmes) est essentiel pour la traçabilité réglementaire et les analyses post-cycle. La résolution temporelle atteint la seconde pour les cycles longs, la dixième de seconde pour les cycles rapides.
4.3 Systèmes de monitoring en temps réel
Les systèmes de monitoring en temps réel transforment les autoclaves industriels en équipements intelligents capables d’auto-surveillance, de diagnostic prédictif et d’optimisation continue. Ces systèmes intègrent des capteurs multiples, des unités de traitement performantes et des interfaces de communication avancées.
L’acquisition de données s’effectue à haute fréquence (1-10 Hz) pour capturer les phénomènes transitoires et calculer précisément les intégrales thermiques. Les signaux analogiques sont numérisés par des convertisseurs 16-24 bits qui garantissent une résolution suffisante pour les calculs de F₀. Le filtrage numérique élimine les bruits haute fréquence tout en préservant la dynamique des signaux utiles.
Le traitement des données s’appuie sur des processeurs multicœurs qui exécutent simultanément les fonctions de régulation, de calcul, de surveillance et de communication. Les algorithmes de détection d’anomalies comparent en permanence les signaux mesurés à des modèles de référence et identifient les dérives naissantes. L’analyse spectrale des vibrations et des pressions permet la détection précoce de défaillances mécaniques (pompes, vannes, compresseurs).
La visualisation en temps réel utilise des interfaces graphiques haute résolution qui affichent simultanément : courbes temporelles des paramètres principaux, vues synoptiques de l’installation, indicateurs de performance (F₀, rendement énergétique, temps de cycle), alarmes actives et historiques. L’ergonomie privilégie la lisibilité et la réactivité pour faciliter la supervision par les opérateurs.
L’historisation des données couvre tous les paramètres critiques sur des périodes étendues (plusieurs années). Les bases de données temporelles optimisées permettent la compression sans perte et l’indexation rapide pour les requêtes d’analyse. Les sauvegardes automatiques sur supports redondants garantissent la pérennité des données réglementaires.
La communication avec les systèmes d’information d’entreprise s’effectue par protocoles standardisés (OPC-UA, Modbus TCP, MQTT) qui garantissent l’interopérabilité et la pérennité. Les données sont structurées selon des modèles sémantiques qui facilitent l’intégration dans les bases de données de production et de qualité.
4.4 Sécurités et alarmes techniques
Les systèmes de sécurité des autoclaves industriels intègrent plusieurs niveaux de protection pour prévenir les risques liés à la pression, à la température et aux dysfonctionnements techniques. Ces dispositifs répondent aux normes de sécurité les plus strictes (EN 285, ASME VIII, Directive Équipements sous Pression) et font l’objet de vérifications périodiques par des organismes accrédités.
Les protections contre la surpression utilisent des soupapes de sécurité calibrées et plombées qui s’ouvrent automatiquement en cas de dépassement de la pression maximale admissible (PMA). Le dimensionnement des soupapes suit les codes de calcul ASME ou EN et tient compte des débits de vapeur maximaux possibles. Des pressiostats de sécurité indépendants du système de régulation déclenchent l’arrêt d’urgence et l’ouverture de vannes de décharge en cas de dysfonctionnement de la régulation principale.
Dispositifs de sécurité obligatoires :
- Soupapes de sécurité : ouverture à PMA + 10%
- Pressiostats de sécurité : seuils indépendants
- Thermostats de sécurité : limitation température
- Contrôle niveau générateur vapeur
- Arrêt d’urgence accessible
- Verrouillage porte sous pression
Les protections thermiques comprennent des thermostats de sécurité indépendants qui coupent l’alimentation énergétique en cas de surchauffe. Ces dispositifs sont réglés 10-20°C au-dessus de la température normale de fonctionnement et nécessitent un réarmement manuel après déclenchement. Des systèmes de refroidissement d’urgence (aspersion d’eau, ventilation forcée) peuvent être activés automatiquement pour accélérer le retour à des conditions sûres.
Les verrouillages de sécurité empêchent l’ouverture des portes tant que la pression interne dépasse 0,3 bar manométrique. Ces systèmes mécaniques à sécurité positive ne peuvent être neutralisés et font l’objet de tests fonctionnels quotidiens. Des capteurs de position vérifient la fermeture correcte des portes avant autorisation de mise en pression.
Le système d’alarmes hiérarchise les événements selon leur criticité : informations (fin de cycle, changement de phase), avertissements (dérive de paramètres), alarmes (dépassement de seuils) et alarmes critiques (risques sécuritaires). Chaque niveau déclenche des actions spécifiques : signalisation visuelle/sonore, enregistrement historique, transmission vers systèmes de supervision, arrêt automatique de cycle.
La maintenance prédictive s’appuie sur l’analyse continue des signaux pour détecter les signes précurseurs de défaillances. L’évolution des temps de réponse des vannes, des niveaux de vibration des pompes et des profils thermiques révèle l’état de santé des composants. Des algorithmes d’apprentissage automatique identifient les patterns anormaux et planifient automatiquement les interventions préventives.
5. APPLICATIONS PHARMACEUTIQUES
L’industrie pharmaceutique impose les exigences les plus strictes en matière de stérilisation, avec des réglementations harmonisées au niveau international et des standards de qualité qui ne tolèrent aucun compromis. Les autoclaves industriels pharmaceutiques intègrent des technologies de pointe et des systèmes de validation exhaustifs pour garantir la stérilité des médicaments et la sécurité des patients.
5.1 Stérilisation équipements production
La stérilisation des équipements de production pharmaceutique représente un défi technique majeur en raison de la diversité des matériaux, des configurations complexes et des exigences de validation. Les équipements concernent les bioréacteurs, les systèmes de filtration, les réseaux de distribution d’eau pour injection (EPPI), les systèmes de remplissage aseptique et l’instrumentation de process.
Les bioréacteurs de production de médicaments biologiques nécessitent une stérilisation in situ (SIP – Sterilization In Place) par circulation de vapeur dans tous les circuits. Cette approche évite le démontage des équipements et garantit la stérilisation des zones difficilement accessibles. La vapeur propre (conforme aux standards pharmaceutiques) circule dans les cuves, agitateurs, sondes et tuyauteries selon des protocoles validés qui assurent l’atteinte des conditions stérilisantes (F₀ ≥ 12) en tous points du système.
Les systèmes de filtration stérilisante font l’objet de protocoles spécifiques qui préservent l’intégrité des membranes tout en assurant la stérilisation des supports et boîtiers. La montée en température progressive (1-2°C/minute) évite les chocs thermiques qui pourraient fissurer les membranes céramiques ou polymères. Le test d’intégrité post-stérilisation (point de bulle, diffusion) vérifie que les performances de filtration sont préservées.
Paramètres SIP pour équipements pharmaceutiques :
- Température : 121-134°C selon matériaux
- F₀ minimum : 12 minutes (SAL 10⁻⁶)
- Vapeur propre : conductivité < 5 µS/cm
- Montée température : 1-3°C/minute
- Drainage complet : vérification visuelle
- Étanchéité résiduelle : test hélium/azote
Les réseaux d’eau pour injection (EPPI) intègrent des boucles de distribution maintenues en permanence à 80-85°C pour prévenir la prolifération microbienne. La stérilisation périodique à 121°C élimine les biofilms et garantit la qualité microbiologique. Les matériaux (acier inoxydable 316L électropoli) et les assemblages (soudures orbitales, raccords sanitaires) sont spécifiés pour résister aux cyclages thermiques sans corrosion ni relâchement de particules.
Les systèmes de remplissage aseptique nécessitent une stérilisation complète avant chaque campagne de production. Les chambres d’isolement, les systèmes de convoyage, les buses de remplissage et les détecteurs sont stérilisés par vapeur ou vapeur de peroxyde d’hydrogène selon leur compatibilité matérielle. La validation de la stérilisation s’appuie sur des indicateurs biologiques positionnés aux points critiques et des tests de stérilité sur des milieux témoins.
L’instrumentation de process (capteurs de pression, température, débit, pH) fait l’objet de procédures de stérilisation adaptées à chaque technologie. Les capteurs céramiques résistent aux conditions sévères tandis que les capteurs polymères nécessitent des cycles adoucis. La dérive des étalonnages post-stérilisation est caractérisée et compensée par des corrections automatiques.
5.2 Validation selon normes FDA/EMA
La validation des processus de stérilisation selon les normes FDA (Food and Drug Administration) et EMA (European Medicines Agency) suit des protocoles rigoureux qui s’appuient sur des approches scientifiques et statistiques robustes. Cette validation constitue un prérequis réglementaire incontournable pour la commercialisation des produits pharmaceutiques.
La qualification d’installation (QI) vérifie que l’autoclave est construit, installé et configuré conformément aux spécifications approuvées. Cette phase documente exhaustivement tous les composants, leurs caractéristiques techniques, leurs numéros de série et leurs certificats de conformité. Les plans, schémas et manuels sont contrôlés et archivés. Les utilités (vapeur, air comprimé, électricité, eau) sont qualifiées avant raccordement.
La qualification opérationnelle (QO) démontre que l’autoclave fonctionne correctement dans toutes les conditions d’utilisation prévues. Les tests incluent : vérification des alarmes et sécurités, étalonnage de tous les instruments de mesure, tests de fuite d’enceinte, validation des cycles à vide, caractérisation des profils thermiques, vérification des interfaces utilisateur et des systèmes de traçabilité. Chaque fonction fait l’objet de protocoles détaillés avec critères d’acceptation quantifiés.
La qualification de performance (QP) prouve que l’autoclave stérilise efficacement les charges représentatives de la production. Cette phase utilise des indicateurs biologiques calibrés (Geobacillus stearothermophilus, population 10⁶ spores, valeur D₁₂₁ certifiée) positionnés aux points les plus difficiles à stériliser. Les tests couvrent différents types de charges (liquides, solides, emballages) et configurations de chargement (pleine charge, charge partielle, configurations extrêmes).
L’approche statistique de la validation repose sur des plans d’expérience qui optimisent le nombre de tests tout en garantissant la robustesse des conclusions. Les méthodes de surface de réponse permettent d’explorer l’espace des paramètres (température, temps, configuration de charge) et d’identifier les zones d’opération sûres. L’analyse de variance (ANOVA) quantifie l’influence de chaque facteur et leurs interactions.
La documentation de validation suit les standards ICH Q7 et Q9 qui définissent les exigences en matière de gestion des risques qualité. Chaque étape est documentée par des protocoles approuvés a priori, des enregistrements bruts archivés et des rapports de synthèse signés par les responsables qualité. La traçabilité complète permet l’audit par les autorités réglementaires et les inspections de routine.
5.3 Bonnes pratiques fabrication (BPF)
Les Bonnes Pratiques de Fabrication (BPF) ou Good Manufacturing Practices (GMP) constituent le référentiel réglementaire qui gouverne l’utilisation des autoclaves industriels en production pharmaceutique. Ces règles couvrent tous les aspects depuis la conception des équipements jusqu’aux procédures opérationnelles et aux contrôles qualité.
La conception des autoclaves BPF privilégie la facilité de nettoyage et la prévention des contaminations croisées. Les surfaces en contact avec les produits sont réalisées en acier inoxydable 316L électropoli (rugosité Ra < 0,8 µm) qui minimise l’adhésion microbienne et facilite le nettoyage. Les formes évitent les zones de rétention (angles vifs, recoins, surfaces horizontales) et privilégient les écoulements gravitaires pour l’évacuation complète des résidus.
La séparation des flux (propre/sale) évite les contaminations croisées entre les charges stérilisées et non stérilisées. Les autoclaves pass-through (traversants) intègrent des portes d’entrée et de sortie situées dans des zones de propreté différente. Les systèmes de verrouillage empêchent l’ouverture simultanée des deux portes et garantissent l’intégrité de la barrière microbiologique.
Exigences BPF critiques : Surfaces contact acier 316L électropoli, drainage complet sans rétention, séparation flux propre/sale, traçabilité complète des cycles, maintenance préventive documentée, formation du personnel qualifiée.
La traçabilité BPF exige l’enregistrement de tous les paramètres critiques de chaque cycle de stérilisation. Les données (température, pression, temps, F₀) sont horodatées et signées électroniquement selon les standards 21 CFR Part 11. L’intégrité des données est garantie par des systèmes de sauvegarde redondants et des contrôles d’accès hiérarchiques. Toute modification est tracée avec identification de l’auteur et justification de la raison.
Les procédures opératoires standard (SOP) détaillent toutes les opérations depuis la préparation des charges jusqu’à la libération des produits stérilisés. Ces procédures couvrent : préparation et emballage des produits, chargement selon configurations validées, sélection et démarrage des cycles appropriés, surveillance et intervention en cas d’alarme, déchargement et transfert vers zones de stockage, archivage de la documentation.
La formation du personnel suit des programmes structurés qui couvrent les aspects techniques, réglementaires et sécuritaires. La compétence des opérateurs est évaluée par des tests théoriques et pratiques avant habilitation. Un système de recyclage annuel maintient les connaissances à jour. Toute intervention sur les équipements critiques nécessite une double vérification par du personnel habilité.
5.4 Qualification installation/opération
La qualification des autoclaves pharmaceutiques suit une approche systématique en trois phases (QI, QO, QP) qui garantit que l’équipement répond à tous les besoins utilisateur et aux exigences réglementaires. Cette démarche structurée minimise les risques de non-conformité et facilite les inspections réglementaires.
La phase de Qualification d’Installation (QI) commence dès la réception de l’équipement et vérifie la conformité physique à la spécification d’achat. Les contrôles incluent : dimensions et poids, matériaux de construction et finitions de surface, instruments de mesure et leurs certificats d’étalonnage, systèmes de sécurité et leur fonctionnement mécanique, documentation technique (plans, manuels, certificats). Chaque élément fait l’objet d’une fiche de contrôle avec photos et mesures documentées.
L’installation proprement dite vérifie les raccordements aux utilités selon les spécifications techniques. Les débits, pressions et qualités de vapeur, d’air comprimé et d’eau de refroidissement sont mesurés et comparés aux requis. L’étanchéité des circuits sous pression est testée conformément aux codes en vigueur. Les systèmes électriques font l’objet de vérifications d’isolement, de continuité des masses et de fonctionnement des protections.
Tests QI typiques :
- Vérification conformité plans/réalisation
- Contrôle matériaux et finitions
- Test étanchéité circuits : 1,5 x PMA
- Étalonnage instruments ±0,1% pleine échelle
- Test sécurités : seuils et cinétiques
- Raccordements utilités selon spécification
La Qualification Opérationnelle (QO) démontre que tous les systèmes fonctionnent correctement dans les conditions d’utilisation prévues. Les tests de montée en température vérifient les cinétiques et l’homogénéité thermique à vide et en charge. Les tests de vide caractérisent les performances de pompage et les étanchéités résiduelles. Les systèmes de régulation sont testés en réponse à des perturbations contrôlées (variation charge, panne utilité).
Les interfaces utilisateur font l’objet de tests exhaustifs : fonctionnement des écrans tactiles, cohérence des affichages, logique des menus, gestion des droits d’accès, archivage des données. Les systèmes d’alarme sont testés par simulation de tous les défauts possibles avec vérification des seuils, temporisations et actions automatiques associées.
La cartographie thermique constitue un élément clé de la QO. Des capteurs étalonnés (précision ±0,1°C) sont répartis dans tout le volume utile de l’enceinte selon une grille tridimensionnelle. Plusieurs cycles sont réalisés avec différentes configurations de charge pour identifier les zones froides et caractériser l’homogénéité spatiale et temporelle. Ces données alimentent la définition des positions d’indicateurs biologiques pour la qualification de performance.
La Qualification de Performance (QP) valide l’efficacité stérilisante sur des charges représentatives de la production. Cette phase utilise des challenges microbiologiques calibrés : indicateurs biologiques à population définie (10⁶ spores), souches de référence traçables (ATCC), résistance thermique certifiée. Les essais couvrent les configurations extrêmes (charges maximales et minimales) et les conditions dégradées (panne partielle, variation utilités).
6. APPLICATIONS INDUSTRIE ALIMENTAIRE
L’industrie alimentaire utilise massivement les autoclaves industriels pour la stérilisation des conserves, des plats cuisinés et des produits à durée de vie prolongée. Cette application, historiquement la première développée, a évolué vers des technologies sophistiquées qui préservent les qualités nutritionnelles et organoleptiques tout en garantissant la sécurité microbiologique.
6.1 Conserverie et stérilisation produits
La stérilisation des conserves alimentaires représente l’application industrielle la plus ancienne et la plus massive des autoclaves. Cette technologie permet de détruire tous les micro-organismes pathogènes et d’altération, notamment Clostridium botulinum, pour obtenir des produits stable à température ambiante avec des durées de conservation de plusieurs années.
Les autoclaves alimentaires sont conçus pour traiter de grandes quantités de produits emballés (boîtes métalliques, bocaux verre, barquettes plastique, poches souples) selon des cycles optimisés qui minimisent la dégradation thermique. Les enceintes horizontales de 1 à 10 m³ accueillent des paniers ou chariots standardisés qui facilitent la manutention et garantissent une circulation homogène de la vapeur ou de l’eau de process.
Les cycles de stérilisation alimentaire suivent des barèmes spécifiques calculés selon la nature du produit, le pH, la charge microbienne initiale et le type d’emballage. Les légumes peu acides (pH > 4,6) nécessitent des traitements sévères (121°C pendant 20-60 minutes) pour éliminer les spores de Clostridium botulinum. Les fruits acides (pH < 4,6) peuvent être traités à des températures plus douces (85-100°C) car l’acidité inhibe la croissance des pathogènes sporulés.
La montée en température contrôlée évite la déformation des emballages et la sur-cuisson des produits. Les autoclaves modernes utilisent des profils de température variables qui accélèrent la phase de pénétration thermique tout en limitant l’exposition aux hautes températures. Les systèmes de brassage ou de rotation favorisent les échanges thermiques et réduisent les gradients de température dans les produits volumineux.
Le refroidissement après stérilisation s’effectue par pulvérisation d’eau froide sous pression maintenue pour éviter l’éclatement des emballages. Cette phase critique doit être maîtrisée pour préserver l’intégrité des sertis des boîtes métalliques et l’étanchéité des bocaux verre. Les vitesses de refroidissement optimales (5-15°C/minute) minimisent le stress thermomécanique tout en limitant la poursuite de la cuisson.
6.2 Normes HACCP et sécurité alimentaire
L’application des principes HACCP (Hazard Analysis Critical Control Point) à la stérilisation industrielle impose une approche systématique d’identification et de maîtrise des dangers microbiologiques, chimiques et physiques. Cette méthodologie, obligatoire dans la plupart des pays, structure l’ensemble du processus de production depuis la réception des matières premières jusqu’à la distribution des produits finis.
L’analyse des dangers identifie Clostridium botulinum comme le pathogène de référence pour les conserves peu acides. Cette bactérie anaérobie sporulée produit des toxines mortelles et sa résistance thermique détermine les barèmes de stérilisation. D’autres pathogènes comme Bacillus cereus, Clostridium perfringens ou les spores de moisissures thermoresistantes sont également considérés selon la nature des produits.
Les points critiques pour la maîtrise (CCP) incluent obligatoirement la température et la durée de stérilisation, mesurées en continu et enregistrées automatiquement. Les limites critiques correspondent aux valeurs F₀ minimales calculées pour chaque type de produit : F₀ = 3-5 minutes pour les conserves acides, F₀ = 8-15 minutes pour les conserves peu acides selon leur pH et leur composition.
Points critiques HACCP en stérilisation :
- Température de stérilisation : ±1°C de la consigne
- Durée d’exposition : selon barème validé
- Intégrité emballages : inspection visuelle
- Refroidissement : < 40°C en 30 minutes
- Étanchéité sertis : contrôle dimensionnel
- Tests de stérilité : échantillonnage statistique
La surveillance continue s’appuie sur des systèmes automatisés qui enregistrent tous les paramètres critiques avec une fréquence adaptée (1-10 secondes selon la cinétique du processus). Les sondes de température sont positionnées aux points les plus froids identifiés lors de la validation. Les déviations par rapport aux limites critiques déclenchent des alarmes immédiates et peuvent provoquer l’arrêt automatique du cycle.
Les actions correctives sont prédéfinies et documentées pour chaque type de déviation. Un dépassement de température peut conduire à une prolongation automatique du cycle pour compenser le déficit de létalité. Un sous-traitement avéré impose le retraitement complet ou la destruction des lots affectés. Toutes les actions sont tracées et font l’objet de rapports de non-conformité.
6.3 Technologies pour différents emballages
La diversification des emballages alimentaires impose des adaptations technologiques spécifiques des autoclaves industriels. Chaque matériau d’emballage présente des contraintes particulières en termes de résistance thermique, de perméabilité et de déformation sous pression, nécessitant des cycles optimisés et des équipements dédiés.
Les emballages métalliques (boîtes acier, aluminium) résistent bien aux conditions de stérilisation mais nécessitent un contrôle strict de la pression externe pour éviter la déformation. Les autoclaves utilisent de l’eau sous pression (eau-vapeur ou eau surchauffée) pour maintenir une contre-pression qui équilibre la pression interne des emballages. Cette technologie permet de traiter des produits gazéifiés ou des emballages de forme complexe.
Les emballages verre présentent une excellente inertie chimique mais une fragilité aux chocs thermiques. Les cycles de stérilisation privilégient des montées et descentes en température progressives (2-5°C/minute) pour éviter les contraintes thermiques excessives. Les systèmes de manutention utilisent des paniers amortissants et des revêtements antichoc pour minimiser les risques de bris.
Les emballages plastique souples (polyamide, polypropylène, complexes multicouches) nécessitent des technologies avancées pour compenser leur faible résistance mécanique. Les autoclaves rotatifs immergent les emballages dans de l’eau chaude tout en les faisant tourner pour homogénéiser le traitement thermique. La rotation évite la formation de points chauds et améliore la pénétration thermique dans les produits visqueux.
Les technologies à micro-ondes assistées commencent à être utilisées pour accélérer le chauffage interne des produits tout en limitant la surchauffe des surfaces. Cette approche hybride combine les avantages de la stérilisation vapeur classique (efficacité microbicide) et du chauffage micro-ondes (rapidité, homogénéité) pour obtenir des produits de qualité supérieure avec des temps de traitement réduits.
6.4 Contrôle qualité microbiologique
Le contrôle qualité microbiologique constitue l’élément de validation final de l’efficacité des traitements de stérilisation. Ces contrôles s’appuient sur des méthodes normalisées et des critères stricts qui garantissent la sécurité des consommateurs et la conformité réglementaire des produits commercialisés.
Les tests de stérilité commerciale utilisent des méthodes d’incubation accélérée qui révèlent la présence de micro-organismes survivants. Les échantillons sont incubés à différentes températures (35°C, 55°C) pendant 7 à 14 jours pour détecter les micro-organismes mésophiles et thermophiles. L’absence de croissance microbienne visible (trouble, gaz, odeur) et la stabilité du pH confirment l’efficacité de la stérilisation.
L’échantillonnage statistique suit des plans conformes aux normes ISO 2859 qui déterminent le nombre d’unités à contrôler selon la taille des lots et le niveau de qualité acceptable. Les plans renforcés appliqués aux produits à risque peuvent exiger le contrôle de plusieurs centaines d’unités par lot de production. Cette approche statistique quantifie le risque résiduel et guide les décisions de libération ou de quarantaine des lots.
Les méthodes de détection rapide utilisent des techniques moléculaires (PCR, séquençage) ou immunologiques (ELISA) pour identifier et quantifier les micro-organismes en quelques heures au lieu de plusieurs jours. Ces approches accélèrent considérablement la libération des lots tout en maintenant une sensibilité analytique équivalente aux méthodes conventionnelles.
La validation microbiologique des nouveaux produits s’appuie sur des études d’inoculation contrôlée qui utilisent des cocktails de souches pathogènes représentatives. Ces études déterminent les paramètres de stérilisation minimaux (température, temps) nécessaires pour atteindre les niveaux de réduction requis. Les résultats alimentent les modèles prédictifs qui permettent l’extrapolation à d’autres formulations ou emballages similaires.
7. APPLICATIONS MÉDICALES HOSPITALIÈRES
Le secteur médical hospitalier représente l’application la plus critique des autoclaves industriels, où la stérilisation des dispositifs médicaux réutilisables conditionne directement la sécurité des patients et la prévention des infections nosocomiales. Les exigences de performance, de traçabilité et de fiabilité atteignent leur niveau maximal dans ce domaine d’application.
7.1 Centraux de stérilisation hospitaliers
Les centraux de stérilisation hospitaliers constituent le cœur névralgique de la lutte contre les infections nosocomiales. Ces unités centralisées traitent quotidiennement des milliers d’instruments chirurgicaux, de dispositifs médicaux et de matériels textiles selon des procédures strictement codifiées et une organisation logistique optimisée.
L’organisation des centraux respecte le principe de marche en avant avec séparation stricte des circuits : zone de réception et lavage des instruments souillés, zone de conditionnement et emballage, zone de stérilisation, zone de stockage stérile et distribution. Cette séparation physique et organisationnelle prévient les contaminations croisées et garantit l’intégrité de la chaîne de stérilisation.
Les autoclaves hospitaliers privilégient la technologie pré-vide qui garantit une pénétration optimale de la vapeur dans les instruments complexes à lumières creuses (endoscopes, trocarts, canules). Les enceintes de 200 à 1000 litres permettent de traiter simultanément plusieurs plateaux d’instruments ou des charges textiles importantes. Les cycles rapides (15-30 minutes) optimisent la rotation des instruments et minimisent l’immobilisation du matériel.
Les systèmes de chargement automatisés réduisent la pénibilité du travail et améliorent la productivité. Des robots de manutention transfèrent automatiquement les chariots depuis les zones de conditionnement vers les autoclaves puis vers les zones de stockage. Cette automatisation minimise les interventions humaines et réduit les risques de contamination manuelle des charges stérilisées.
Performances typiques centraux hospitaliers :
- Capacité : 3-8 autoclaves de 300-1000L
- Productivité : 50-200 cycles/jour
- Personnel : 2-3 agents par équipe
- Délai moyen : 2-4h réception/distribution
- Disponibilité : > 98% (maintenance incluse)
- Traçabilité : 100% des instruments
La traçabilité individuelle des instruments utilise des puces RFID ou des codes-barres 2D qui permettent le suivi unitaire depuis le lavage jusqu’à l’utilisation clinique. Cette traçabilité facilite la gestion des stocks, optimise les flux et permet la localisation immédiate de tout instrument en cas d’incident ou de rappel. Les systèmes informatiques intégrés corrèlent les données de stérilisation avec l’historique d’utilisation de chaque instrument.
L’assurance qualité s’appuie sur des contrôles systématiques : tests de Bowie-Dick quotidiens pour vérifier l’évacuation de l’air, indicateurs biologiques hebdomadaires pour confirmer l’efficacité stérilisante, contrôles de propreté par ATP-métrie, vérification de l’intégrité des emballages stériles. Ces contrôles alimentent des tableaux de bord qualité qui orientent les actions d’amélioration continue.
7.2 Stérilisation instruments chirurgicaux
La stérilisation des instruments chirurgicaux représente l’application la plus exigeante des autoclaves médicaux en raison de la diversité des matériaux, de la complexité des géométries et des contraintes de préservation des propriétés fonctionnelles. Cette stérilisation conditionne directement la sécurité des actes chirurgicaux et la prévention des infections post-opératoires.
Les instruments chirurgicaux modernes intègrent des matériaux sophistiqués : aciers inoxydables martensitiques pour les lames et tranchants, alliages de titane pour la compatibilité IRM, revêtements céramiques pour la biocompatibilité, polymères haute performance pour l’isolation électrique. Chaque matériau impose des contraintes spécifiques de température, de vitesse de chauffage et de conditionnement atmosphérique.
Les instruments à géométrie complexe (ciseaux articulés, pinces microchirurgicales, instruments endoscopiques) nécessitent un démontage partiel et un positionnement spécifique pour garantir l’accès de la vapeur à toutes les surfaces. Les procédures de conditionnement détaillent précisément les opérations de démontage, nettoyage, inspection, emballage et positionnement dans les paniers de stérilisation.
Les cycles de stérilisation sont adaptés à chaque famille d’instruments : cycle standard 134°C/3,5 minutes pour l’instrumentation générale, cycle adouci 121°C/15 minutes pour les instruments sensibles, cycles spéciaux pour les optiques (gradients thermiques limités) et les dispositifs implantables (validation renforcée). Cette diversification optimise la préservation des instruments tout en garantissant l’efficacité stérilisante.
Le séchage des instruments revêt une importance critique pour prévenir la corrosion et faciliter la manipulation aseptique. Les autoclaves médicaux intègrent des systèmes de séchage performants : vide final poussé (< 20 mbar), injection d’air stérile filtré, chauffage des parois de l’enceinte. La durée de séchage (10-30 minutes) est adaptée à la nature des instruments et aux exigences de stockage stérile.
7.3 Normes EN 285 et ISO 17665
Les normes européennes EN 285 et internationales ISO 17665 constituent le référentiel technique qui régit la conception, l’installation, la validation et l’utilisation des autoclaves à vapeur dans le domaine médical. Ces normes harmonisent les exigences à l’échelle internationale et garantissent un niveau de sécurité uniforme pour les patients.
La norme EN 285 spécifie les exigences de performance pour les gros autoclaves à vapeur d’eau destinés à la stérilisation des dispositifs médicaux. Cette norme couvre la conception des enceintes (calcul de résistance, matériaux, assemblages), les systèmes de sécurité (soupapes, pressiostats, verrouillages), les performances thermiques (homogénéité, cinétiques) et les systèmes de contrôle (précision, fiabilité, traçabilité).
Les tests de qualification selon EN 285 incluent des épreuves rigoureuses : tests de fuite d’enceinte (< 1,3 mbar/minute), tests d’évacuation de l’air (Bowie-Dick), tests de pénétration de la vapeur (hélix test), tests de performance thermique avec charges standard. Ces tests utilisent des protocoles standardisés avec des charges d’épreuve normalisées qui permettent la comparaison objective des performances.
Exigences EN 285 principales :
- Étanchéité : < 1,3 mbar/min à 2 bar
- Homogénéité thermique : ±1°C en tout point
- Pénétration vapeur : test hélix validé
- Sécurité : soupapes + pressiostats indépendants
- Traçabilité : enregistrement paramètres
- Maintenance : programme préventif documenté
La norme ISO 17665 adopte une approche plus globale qui couvre l’ensemble du processus de stérilisation depuis le développement et la validation jusqu’à l’utilisation de routine et la libération des dispositifs médicaux. Cette norme privilégie l’approche par les risques et l’amélioration continue des processus plutôt que la simple conformité à des exigences techniques.
L’analyse des risques selon ISO 17665 identifie tous les dangers potentiels liés à la stérilisation : sous-traitement (survie microbienne), sur-traitement (dégradation des dispositifs), contaminations croisées, erreurs humaines, défaillances techniques. Chaque risque fait l’objet d’une évaluation quantitative et de mesures de maîtrise proportionnelles à sa criticité.
La validation selon ISO 17665 suit une approche documentée en trois phases similaire à celle des BPF pharmaceutiques : qualification d’installation (QI), qualification opérationnelle (QO) et qualification de performance (QP). Cette validation est complétée par une revalidation périodique et une revalidation après toute modification significative des équipements ou des procédures.
7.4 Traçabilité et documentation
La traçabilité et la documentation constituent les piliers de l’assurance qualité en stérilisation hospitalière. Ces exigences réglementaires permettent de démontrer a posteriori que chaque dispositif médical a été correctement stérilisé et de retracer l’origine de tout problème de sécurité sanitaire.
L’enregistrement des paramètres de stérilisation s’effectue en continu avec une résolution temporelle adaptée à la cinétique des cycles (1-10 secondes). Les données critiques (température, pression, temps, F₀) sont horodatées avec une précision de la seconde et signées numériquement pour garantir leur intégrité. L’archivage redondant sur supports multiples assure la pérennité des données sur la durée de conservation légale (30 ans pour les dispositifs implantables).
L’identification univoque de chaque cycle utilise un numérotage séquentiel incrémental qui permet la corrélation avec tous les événements associés : composition de la charge, résultats de contrôles, incidents éventuels, destination finale des dispositifs stérilisés. Cette numérotation intègre des codes de contrôle qui détectent les erreurs de transcription et garantissent l’unicité des références.
La traçabilité descendante permet de retrouver tous les dispositifs issus d’un cycle donné en cas de suspicion de problème de stérilisation. Cette traçabilité s’appuie sur l’étiquetage des emballages stériles avec le numéro de cycle et la date de péremption. Les systèmes informatiques hospitaliers corrèlent ces données avec l’utilisation clinique pour localiser instantanément les dispositifs concernés.
La traçabilité ascendante reconstitue l’historique complet d’un dispositif depuis sa fabrication jusqu’à son utilisation. Cette reconstitution inclut : origine et traçabilité du fabricant, étapes de retraitement (nettoyage, conditionnement), paramètres de stérilisation, contrôles de libération, conditions de stockage et de transport. Cette traçabilité bidirectionnelle facilite les enquêtes épidémiologiques et les procédures de rappel.
8. VALIDATION ET CONTRÔLE QUALITÉ
La validation et le contrôle qualité constituent les fondements de l’assurance stérilité et de la conformité réglementaire des processus de stérilisation industrielle. Ces approches scientifiques rigoureuses démontrent objectivement l’efficacité des traitements et garantissent la reproductibilité des performances dans le temps.
8.1 Indicateurs biologiques Geobacillus stearothermophilus
Geobacillus stearothermophilus (anciennement Bacillus stearothermophilus) constitue le micro-organisme de référence pour la validation de la stérilisation vapeur en raison de sa résistance thermique exceptionnelle et de sa sporulation régulière. Cette bactérie thermophile forme des spores particulièrement résistantes à la chaleur humide, ce qui en fait un indicateur biologique idéal pour démontrer l’efficacité des cycles de stérilisation.
Les spores de G. stearothermophilus présentent une valeur D₁₂₁ (temps de réduction décimale à 121°C) comprise entre 1,5 et 2,5 minutes selon les souches et les conditions de préparation. Cette résistance thermique, supérieure à celle de la plupart des pathogènes sporulés rencontrés naturellement, garantit une marge de sécurité confortable pour la validation des processus. La valeur z (coefficient de température) de 10°C permet l’extrapolation des résultats à différentes températures de stérilisation.
La préparation des indicateurs biologiques suit des procédures strictement contrôlées qui garantissent la reproductibilité des populations sporulées. Les spores sont cultivées sur des milieux nutritifs standardisés, récoltées en phase stationnaire, purifiées par centrifugation et lavages répétés, puis calibrées par comptage sur milieux gélosés. La population finale (10⁴ à 10⁶ spores par unité) est certifiée par des laboratoires accrédités avec traçabilité métrologique.
Caractéristiques indicateurs biologiques G. stearothermophilus :
- Population : 10⁶ spores ±0,5 log
- Valeur D₁₂₁ : 1,5-2,5 minutes
- Valeur z : 7-13°C (moyenne 10°C)
- Support : papier filtre, céramique, verre
- Conditionnement : sachets aluminium étanches
- Conservation : -20°C ou lyophilisé
Le positionnement des indicateurs biologiques dans les charges suit une méthodologie rigoureuse basée sur la cartographie thermique préalable. Les indicateurs sont placés aux points identifiés comme les plus difficiles à stériliser (points froids, zones d’ombre thermique, centres géométriques des charges volumineuses). Cette stratégie de positionnement garantit que la validation couvre les conditions les plus défavorables de la stérilisation.
L’incubation post-stérilisation s’effectue dans des conditions optimales pour la croissance de G. stearothermophilus : milieu de culture riche (bouillon tryptone-soja), température 55-60°C, durée 7 jours minimum. Les indicateurs témoins non traités doivent présenter une croissance positive dans les 24-48 heures pour valider la viabilité du lot. L’absence de croissance des indicateurs traités après 7 jours d’incubation confirme l’efficacité de la stérilisation.
Les systèmes d’indicateurs biologiques auto-contenus intègrent le milieu de culture dans l’ampoule de spores, permettant l’incubation directe après activation post-stérilisation. Cette technologie simplifie la manipulation, réduit les risques de contamination croisée et accélère l’obtention des résultats. Des indicateurs fluorescents permettent la détection de croissance en quelques heures par mesure de l’activité enzymatique.
8.2 Tests de pénétration vapeur
Les tests de pénétration vapeur évaluent l’efficacité de l’évacuation de l’air et la capacité de la vapeur à atteindre toutes les zones de la charge de stérilisation. Ces tests constituent un prérequis indispensable à la validation microbiologique car ils garantissent que les conditions physiques nécessaires à la stérilisation sont réunies en tout point de l’enceinte.
Le test de Bowie-Dick, référence historique pour les autoclaves à pré-vide, utilise une pile de serviettes textiles au centre de laquelle est placée une feuille indicatrice chimique sensible à la vapeur. Ce test révèle la présence d’air résiduel par l’apparition de zones non colorées sur l’indicateur. Un test satisfaisant montre un changement de couleur homogène sur toute la surface, attestant d’une pénétration uniforme de la vapeur.
Les tests de pénétration modernes utilisent des paquets d’épreuve standardisés qui reproduisent fidèlement les conditions de pénétration des charges réelles. Ces paquets, constitués de textiles normalisés (coton, polyester) disposés selon des configurations précises, intègrent des indicateurs chimiques et physiques positionnés à différentes profondeurs. L’analyse des résultats révèle les gradients de pénétration et identifie les zones critiques.
Le test hélix (Helix test) évalue spécifiquement la pénétration de la vapeur dans des lumières creuses de faible diamètre, représentatives des instruments médicaux complexes. Ce test utilise un tube métallique de 1,5 mm de diamètre interne et 1500 mm de longueur, enroulé en spirale, avec un indicateur biologique ou chimique placé à l’extrémité fermée. La stérilisation efficace de cet indicateur démontre la capacité de pénétration dans les géométries les plus contraignantes.
Les capteurs de température et pression sans fil révolutionnent les tests de pénétration en permettant la mesure en temps réel des conditions physiques au cœur des charges. Ces capteurs miniaturisés, résistants à la vapeur et aux hautes températures, transmettent leurs données par radiofréquence vers des récepteurs externes. L’analyse des courbes temporelles révèle précisément les cinétiques de pénétration et les retards par rapport aux conditions d’enceinte.
8.3 Cartographie thermique chambres
La cartographie thermique constitue l’étape fondamentale de la validation qui caractérise la distribution spatiale et temporelle de la température dans tout le volume utile des autoclaves. Cette analyse tridimensionnelle identifie les zones froides, quantifie les gradients thermiques et guide l’optimisation des cycles de stérilisation.
La méthodologie de cartographie suit les recommandations des normes internationales (ISO 17665, EN 285) qui spécifient le nombre et la répartition des points de mesure selon le volume des enceintes. Pour les autoclaves de volume supérieur à 200 litres, un minimum de 16 capteurs est réparti selon une grille tridimensionnelle régulière, avec une densité accrue aux zones périphériques et aux points suspectés d’être critiques.
Les capteurs de température utilisés pour la cartographie répondent à des exigences métrologiques strictes : précision ±0,1°C, résolution 0,01°C, temps de réponse < 5 secondes, dérive < 0,05°C/an. L’étalonnage tracé COFRAC ou équivalent garantit la fiabilité métrologique. Les capteurs sont protégés par des gaines étanches compatibles vapeur et positionnés à l’aide de supports rigides qui évitent les déplacements pendant les cycles.
Spécifications cartographie thermique :
- Nombre capteurs : 16 minimum (> 200L)
- Précision mesure : ±0,1°C tracée
- Résolution temporelle : 1-10 secondes
- Répartition : grille 3D régulière
- Cycles de qualification : 3 minimum
- Charges d’épreuve : vide et représentatives
L’acquisition des données s’effectue à haute fréquence (1-10 Hz) pendant toute la durée des cycles pour capturer les phénomènes transitoires et calculer précisément les valeurs F₀ localisées. Les systèmes d’acquisition modernes utilisent des centrales de mesure multiplexées qui gèrent simultanément plusieurs dizaines de voies avec synchronisation temporelle précise. L’exportation automatique vers des logiciels de traitement facilite l’analyse statistique et la génération de rapports de validation.
L’analyse des données de cartographie révèle les caractéristiques thermiques fondamentales : homogénéité spatiale (écart-type des températures), cinétiques de montée (temps pour atteindre la consigne), zones froides (points présentant systématiquement les températures les plus basses), stabilité temporelle (variations de température au palier). Ces paramètres orientent l’optimisation des cycles et la définition des positions critiques pour les indicateurs biologiques.
La représentation graphique utilise des techniques de visualisation avancées : courbes temporelles multicourbes, cartographies 2D et 3D avec isovaleurs, animations temporelles montrant l’évolution spatiale des températures. Ces représentations facilitent l’interprétation des phénomènes physiques et la communication des résultats aux équipes techniques et réglementaires.
8.4 Protocoles de qualification
Les protocoles de qualification structurent methodiquement la validation des autoclaves industriels selon une approche documentée qui garantit l’exhaustivité des tests et la traçabilité des résultats. Ces protocoles, approuvés par les services qualité et les autorités réglementaires, constituent la référence contractuelle pour l’acceptation des équipements.
La qualification d’installation (QI) vérifie la conformité de l’autoclave livré aux spécifications d’achat et aux exigences réglementaires. Ce protocole documente exhaustivement : caractéristiques techniques (dimensions, matériaux, performances), composants installés (capteurs, vannes, systèmes de sécurité), raccordements aux utilités (vapeur, électricité, air comprimé), systèmes de contrôle et d’acquisition de données. Chaque élément fait l’objet d’une vérification avec critères d’acceptation quantifiés.
La qualification opérationnelle (QO) démontre que tous les systèmes fonctionnent correctement dans les plages d’utilisation spécifiées. Les tests incluent : étalonnage et linéarité des instruments de mesure, fonctionnement des sécurités et alarmes, performance des systèmes de vide et de drainage, cinétiques de montée et descente en température, étanchéité de l’enceinte et des circuits. Ces tests utilisent des charges d’épreuve normalisées et des protocoles reproductibles.
La qualification de performance (QP) valide l’efficacité stérilisante sur des charges représentatives de l’utilisation prévue. Cette phase utilise des indicateurs biologiques calibrés positionnés aux points critiques identifiés lors de la cartographie thermique. Les tests couvrent différentes configurations de charges (minimale, nominale, maximale) et différents cycles de stérilisation (température, durée). La validation statistique exige la stérilisation complète de tous les indicateurs sur un minimum de trois cycles consécutifs.
Les protocoles de requalification périodique maintiennent la validation en cours d’utilisation. Ces protocoles allégés se concentrent sur les paramètres critiques : précision des instruments, efficacité des systèmes de vide, homogénéité thermique, efficacité stérilisante. La fréquence de requalification (semestrielle à annuelle) dépend de l’intensité d’utilisation, de la criticité des applications et des exigences réglementaires sectorielles.
9. MAINTENANCE ET OPTIMISATION
La maintenance et l’optimisation des autoclaves industriels conditionnent directement leur disponibilité opérationnelle, leurs performances techniques et leur conformité réglementaire sur la durée. Une stratégie de maintenance préventive rigoureuse, combinée à des approches d’optimisation continue, maximise la rentabilité des investissements tout en garantissant la sécurité et l’efficacité des processus de stérilisation.
9.1 Maintenance préventive programmée
La maintenance préventive programmée s’appuie sur l’analyse des modes de défaillance et l’expérience opérationnelle pour définir des interventions systématiques qui préviennent les pannes et maintiennent les performances dans le temps. Cette approche proactive minimise les arrêts non planifiés et optimise les coûts de maintenance sur le cycle de vie des équipements.
L’analyse AMDEC (Analyse des Modes de Défaillance, de leurs Effets et de leur Criticité) identifie tous les composants critiques et leurs modes de défaillance potentiels. Cette analyse quantifie le risque de chaque défaillance selon trois critères : probabilité d’occurrence, sévérité des conséquences, facilité de détection. Le produit de ces trois facteurs (indice de criticité) hiérarchise les priorités de maintenance et guide l’allocation des ressources.
Les gammes de maintenance détaillent précisément les opérations à réaliser selon des périodicités définies : quotidiennes (contrôles visuels, nettoyage), hebdomadaires (tests fonctionnels, lubrification), mensuelles (étalonnage, remplacement consommables), trimestrielles (démontage partiel, contrôles approfondis), annuelles (révision générale, épreuve hydraulique). Chaque opération spécifie les outillages, les pièces de rechange et les compétences requises.
Programme maintenance préventive type :
| Fréquence | Opérations principales | Durée arrêt | Personnel |
|---|---|---|---|
| Quotidien | Contrôles visuels, nettoyage | 30 min | Opérateur |
| Hebdomadaire | Tests Bowie-Dick, lubrification | 2h | Technicien |
| Mensuel | Étalonnage, filtres, joints | 4h | Technicien |
| Trimestriel | Vannes, pompe, sécurités | 8h | Spécialiste |
| Annuel | Révision complète, épreuve | 3 jours | Équipe |
La planification des interventions optimise la disponibilité opérationnelle en coordonnant les maintenances avec les besoins de production. Les logiciels de GMAO (Gestion de la Maintenance Assistée par Ordinateur) automatisent la programmation, gèrent les stocks de pièces de rechange et tracent l’historique des interventions. L’intégration avec les systèmes de production permet l’optimisation dynamique des plannings selon les contraintes opérationnelles.
La formation du personnel de maintenance couvre les aspects techniques, sécuritaires et réglementaires spécifiques aux autoclaves. Cette formation certifiante aborde : technologies de génération et distribution vapeur, systèmes de vide et leur maintenance, instrumentation et régulation, sécurité des équipements sous pression, exigences réglementaires sectorielles. La mise à jour des compétences suit l’évolution technologique des équipements.
9.2 Calibration instruments mesure
La calibration des instruments de mesure constitue un élément critique de la maintenance qui garantit la fiabilité des données de process et la conformité métrologique des installations. Cette activité réglementée suit des procédures strictes et fait appel à des étalons traçables aux références nationales et internationales.
Les instruments critiques (température, pression, débit, niveau) font l’objet de calibrations périodiques dont la fréquence dépend de leur criticité, de leur stabilité et des exigences réglementaires. Les capteurs de température utilisés pour la régulation et la validation nécessitent une calibration mensuelle à trimestrielle avec une précision de ±0,1°C. Les transmetteurs de pression sont calibrés semestriellement avec une précision de ±0,1% de l’étendue de mesure.
Les étalons de référence utilisés pour la calibration sont eux-mêmes étalonnés par des laboratoires accrédités COFRAC ou équivalent, garantissant la traçabilité métrologique. Les bains thermostatés de calibration atteignent une stabilité de ±0,01°C et une uniformité spatiale de ±0,02°C. Les manomètres étalons présentent une précision de ±0,025% avec des classes d’exactitude certifiées selon les normes internationales.
Les procédures de calibration détaillent les étapes opératoires : stabilisation thermique des étalons, points de mesure couvrant toute l’étendue d’utilisation, nombre de cycles montant/descendant, critères d’acceptation et de rejet, corrections à appliquer le cas échéant. L’hysteresis, la répétabilité et la dérive long terme sont caractérisées pour évaluer la performance métrologique globale des instruments.
La documentation de calibration comprend les certificats d’étalonnage, les courbes de calibration, les calculs d’incertitude de mesure et les étiquetages de traçabilité. Cette documentation, archivée et traçable, permet de démontrer la conformité métrologique lors des audits réglementaires. Les systèmes informatisés de gestion métrologique automatisent la planification, l’édition des certificats et les alertes de péremption.
9.3 Optimisation énergétique
L’optimisation énergétique des autoclaves industriels répond aux enjeux économiques et environnementaux croissants en réduisant significativement les coûts opérationnels tout en minimisant l’empreinte carbone. Cette démarche s’appuie sur l’analyse fine des consommations et la mise en œuvre de technologies efficientes.
L’audit énergétique quantifie précisément les consommations par poste : génération de vapeur (60-70% du total), système de vide (15-20%), chauffage des utilités (10-15%), auxiliaires (5-10%). Cette répartition guide les priorités d’optimisation vers les postes les plus consommateurs. L’instrumentation de mesure (débitmètres vapeur, compteurs électriques, analyseurs de combustion) fournit les données nécessaires au diagnostic.
La récupération de chaleur sur les condensats constitue le gisement d’économie le plus important. Les condensats à 100°C représentent environ 25% de l’énergie de la vapeur initiale et peuvent être valorisés pour le préchauffage de l’eau d’alimentation des chaudières ou le chauffage des bâtiments. Les échangeurs de chaleur à plaques, compacts et efficaces, permettent de récupérer 70-90% de cette énergie résiduelle.
Potentiels d’économie énergétique : Récupération condensats 20-30%, isolation renforcée 5-10%, optimisation cycles 10-15%, variateurs de vitesse 15-25%, récupération chaleur évents 10-20%. Total : 60-100% de réduction possible.
L’optimisation des cycles réduit les consommations en adaptant précisément les paramètres aux besoins de chaque charge. Les algorithmes d’optimisation multicritères minimisent simultanément la consommation d’énergie et la durée de cycle tout en maintenant l’efficacité stérilisante. L’apprentissage automatique identifie les corrélations entre les caractéristiques des charges et les paramètres optimaux, permettant l’adaptation automatique des cycles.
L’isolation thermique renforcée des enceintes et tuyauteries limite les déperditions vers l’ambiance. Les matériaux isolants haute performance (laines minérales, mousses polyuréthane, aérogels) réduisent les coefficients de transmission thermique de 50-80%. L’isolation des vannes, brides et accessoires, souvent négligée, peut représenter 20% des pertes totales sur les installations complexes.
9.4 Dépannage et diagnostic
Le dépannage et diagnostic des autoclaves industriels nécessitent une approche méthodique qui combine l’analyse des symptômes, la compréhension des phénomènes physiques et la maîtrise des technologies embarquées. Cette expertise technique minimise les temps d’arrêt et optimise la disponibilité opérationnelle des installations critiques.
La méthodologie de diagnostic suit une approche systémique qui hiérarchise les causes potentielles selon leur probabilité et leur facilité de vérification. L’arbre de défaillance structure l’analyse en partant du symptôme observé vers les causes racines possibles. Cette approche logique évite les interventions hasardeuses et oriente efficacement les investigations vers les composants suspects.
Les outils de diagnostic modernes intègrent des fonctions d’auto-diagnostic qui analysent en permanence les signaux de process et détectent automatiquement les anomalies naissantes. Les algorithmes de détection comparent les signatures spectrales des vibrations, les dérives des temps de réponse et les évolutions des consommations énergétiques à des modèles de référence pour identifier les défaillances précoces.
Les pannes récurrentes font l’objet de procédures de dépannage standardisées qui détaillent : symptômes caractéristiques, causes probables hiérarchisées, tests de diagnostic à effectuer, actions correctives par ordre de priorité, pièces de rechange nécessaires. Ces procédures, régulièrement mises à jour avec le retour d’expérience, accélèrent la résolution des incidents et homogénéisent les pratiques d’intervention.
Pannes types et diagnostics :
- Non-atteinte température : sonde défectueuse, manque vapeur, fuite enceinte
- Vide insuffisant : pompe usée, fuite circuit, vanne bloquée
- Séchage défaillant : condensation parois, air pollué, drainage incomplet
- Régulation instable : paramètres PID, capteur dérivé, vanne grippée
- Alarmes intempestives : étalonnage, perturbations électriques, usure contacts
La maintenance prédictive utilise l’intelligence artificielle pour analyser les données historiques et prédire les défaillances avant qu’elles ne surviennent. Les modèles d’apprentissage automatique identifient les patterns précurseurs dans l’évolution des paramètres de fonctionnement et déclenchent des alertes préventives. Cette approche transforme la maintenance de réactive en proactive, optimisant les coûts et la disponibilité.
La télémaintenance permet l’assistance à distance par les constructeurs ou spécialistes via des liaisons sécurisées. L’accès aux données de fonctionnement, paramètres et historiques facilite le diagnostic à distance et accélère la résolution des incidents complexes. Cette technologie réduit les délais d’intervention et capitalise l’expertise des spécialistes au profit de tous les utilisateurs.
10. NORMES ET RÉGLEMENTATIONS
Les normes et réglementations constituent le cadre juridique et technique qui gouverne la conception, l’installation, la validation et l’exploitation des autoclaves industriels. Ce corpus réglementaire, harmonisé au niveau international, garantit la sécurité des personnes, l’efficacité des processus et la qualité des produits stérilisés dans tous les secteurs d’application.
10.1 ISO 17665 (stérilisation vapeur)
La norme ISO 17665 « Stérilisation des produits de santé – Chaleur humide » constitue la référence internationale pour la stérilisation à la vapeur d’eau des dispositifs médicaux. Cette norme adopte une approche systémique qui couvre l’ensemble du processus depuis le développement et la validation jusqu’à l’utilisation de routine et la libération des produits stérilisés.
L’approche par les risques, principe fondamental d’ISO 17665, exige une analyse exhaustive de tous les dangers potentiels associés au processus de stérilisation. Cette analyse identifie : les risques microbiologiques (survie de pathogènes), les risques chimiques (résidus toxiques), les risques physiques (dégradation des produits), les risques opérationnels (erreurs humaines, défaillances techniques). Chaque risque fait l’objet d’une évaluation quantitative et de mesures de maîtrise proportionnées.
La validation selon ISO 17665 suit une démarche structurée en phases : étude de définition (caractérisation des produits, spécification des exigences), qualification d’installation (vérification de conformité), qualification opérationnelle (tests de performance), qualification de performance (validation microbiologique). Cette progression logique garantit que chaque étape s’appuie sur les résultats des précédentes.
Le concept de famille de produits permet d’optimiser les efforts de validation en regroupant des produits présentant des caractéristiques similaires de résistance thermique et de configuration géométrique. Le produit le plus difficile à stériliser (worst case) de chaque famille fait l’objet d’une validation complète dont les résultats sont extrapolés aux autres membres de la famille selon des critères techniques précis.
Exigences clés ISO 17665 :
- Analyse de risques documentée
- Validation microbiologique obligatoire
- Approche « worst case » par famille
- Surveillance continue des paramètres
- Revalidation périodique programmée
- Documentation complète et traçable
La maintenance de la validation exige une surveillance continue des paramètres critiques et une revalidation périodique pour démontrer le maintien des performances dans le temps. Les critères de revalidation incluent : dérive significative des paramètres de process, modifications techniques majeures, changement de gamme de produits, incidents de stérilisation, évolution de l’environnement réglementaire.
10.2 EN 285 (autoclaves grands volumes)
La norme européenne EN 285 « Stérilisation – Autoclaves à vapeur d’eau – Gros autoclaves » spécifie les exigences de conception, de performance et d’essai pour les autoclaves de volume supérieur à 60 litres destinés au traitement des dispositifs médicaux. Cette norme technique détaillée complète ISO 17665 en précisant les spécifications d’ingénierie des équipements.
Les exigences de conception couvrent tous les aspects techniques : calcul de résistance des enceintes selon les codes ASME ou EN, spécification des matériaux (acier inoxydable austénitique, soudures qualifiées), systèmes de sécurité (soupapes, pressiostats redondants), performance thermique (homogénéité, cinétiques de montée), systèmes de contrôle (précision, fiabilité, traçabilité).
Les tests de type selon EN 285 valident la conformité des autoclaves aux spécifications avant leur mise sur le marché. Ces tests normalisés incluent : essais de résistance mécanique (épreuve hydraulique à 1,43 fois la pression de service), tests d’étanchéité (fuite < 1,3 mbar/minute à la pression de service), tests de performance thermique avec charges normalisées, validation du fonctionnement des sécurités et alarmes.
Le test de pénétration de la vapeur (Helix test) constitue une exigence spécifique d’EN 285 qui démontre la capacité de l’autoclave à stériliser des charges à géométrie complexe. Ce test utilise un tube capillaire de 1,5 mm de diamètre et 1500 mm de longueur avec un indicateur biologique à l’extrémité fermée. La stérilisation complète de cet indicateur lors de cycles standardisés valide la performance de pénétration vapeur.
La classification des autoclaves selon EN 285 distingue plusieurs types selon leurs capacités : type B (pré-vide avec séchage, tout type de charge), type N (gravitaire, charges solides non emballées), type S (spécialisé selon définition du fabricant). Cette classification guide le choix des utilisateurs selon leurs besoins spécifiques et les types de charges à traiter.
10.3 Pharmacopées internationales
Les pharmacopées internationales (USP, Ph. Eur., JP) définissent les standards de qualité et les méthodes d’analyse applicables aux produits pharmaceutiques, incluant les exigences spécifiques pour la stérilisation. Ces références réglementaires s’imposent aux fabricants de médicaments et orientent les pratiques industrielles au niveau mondial.
La Pharmacopée Européenne (Ph. Eur.) consacre plusieurs chapitres à la stérilisation : chapitre 5.1.1 « Méthodes de préparation des formes stériles », chapitre 5.1.5 « Application des statistiques à l’assurance qualité », chapitre 2.6.1 « Essai de stérilité ». Ces textes réglementaires précisent les méthodes de validation, les critères d’acceptation et les procédures de contrôle applicables aux produits pharmaceutiques stériles.
L’USP (United States Pharmacopeia) développe des approches complémentaires dans les chapitres <1211> « Sterilization and Sterility Assurance of Compendial Articles » et <1229> « Sterilization of Compendial Articles ». Ces textes mettent l’accent sur les aspects probabilistes de la stérilisation et les méthodes statistiques de validation des processus.
Exigences pharmacopées principales :
- SAL ≤ 10⁻⁶ pour produits terminaux
- Validation statistique des cycles
- Biocharge ≤ 1000 CFU/unité avant stérilisation
- Tests de stérilité selon méthodes officielles
- Documentation de libération paramétrique
- Revalidation après modifications significatives
Le concept de libération paramétrique, reconnu par les pharmacopées modernes, permet la libération de lots stérilisés sur la base exclusive des paramètres physiques du processus (température, temps, F₀) sans attendre les résultats des tests de stérilité. Cette approche, plus rapide et plus fiable que les tests microbiologiques, nécessite une validation initiale exhaustive et une surveillance continue rigoureuse des paramètres critiques.
L’harmonisation internationale des pharmacopées, menée par l’ICH (International Council for Harmonisation), vise à unifier les exigences techniques entre les principales régions réglementaires (États-Unis, Europe, Japon). Cette convergence facilite l’enregistrement mondial des médicaments et réduit la complexité réglementaire pour les industriels multinationaux.
10.4 Certifications et audits
Les certifications et audits constituent les mécanismes de vérification de la conformité réglementaire et de la qualité des processus de stérilisation. Ces évaluations externes, menées par des organismes accrédités et des autorités réglementaires, garantissent l’objectivité des contrôles et la crédibilité des certifications délivrées.
La certification CE des autoclaves selon la Directive Équipements sous Pression (DESP) atteste de leur conformité aux exigences essentielles de sécurité européennes. Cette certification, obligatoire pour la commercialisation en Europe, s’appuie sur l’évaluation de la conformité par des organismes notifiés selon des modules harmonisés (H, H1, B+D, B+F). La surveillance périodique vérifie le maintien de la conformité en production série.
L’accréditation ISO 17025 des laboratoires d’étalonnage et d’essai garantit la compétence technique et l’impartialité des prestations de validation. Cette accréditation couvre : compétence du personnel technique, adéquation des équipements de mesure, traçabilité métrologique des étalons, qualité des procédures d’essai, fiabilité des résultats d’analyse. L’évaluation périodique par les organismes d’accréditation maintient la reconnaissance internationale.
Les audits réglementaires par les autorités de santé (ANSM, FDA, EMA) vérifient la conformité des installations pharmaceutiques aux Bonnes Pratiques de Fabrication. Ces inspections couvrent : conception et qualification des équipements, validation des processus de stérilisation, documentation et traçabilité, formation du personnel, système qualité et amélioration continue. Les observations d’audit peuvent conduire à des mesures correctives obligatoires.
La certification ISO 13485 des systèmes qualité pour les dispositifs médicaux intègre des exigences spécifiques pour la stérilisation : maîtrise des processus spéciaux, validation des équipements, surveillance des performances, actions correctives et préventives. Cette certification, reconnue internationalement, facilite l’accès aux marchés mondiaux et démontre l’engagement qualité des fabricants.
CONCLUSION ET PERSPECTIVES
Les autoclaves industriels représentent aujourd’hui des technologies matures qui ont révolutionné la stérilisation dans les secteurs pharmaceutique, alimentaire et médical. Cette analyse exhaustive de 15,000 mots a démontré la complexité technique et l’importance stratégique de ces équipements dans l’économie moderne et la santé publique.
L’évolution technologique continue pousse ces systèmes vers toujours plus d’efficacité, d’intelligence et de durabilité. L’intégration de l’intelligence artificielle et de l’Internet des Objets (IoT) transforme progressivement les autoclaves en équipements autonomes capables d’auto-optimisation et de maintenance prédictive. Les algorithmes d’apprentissage automatique analysent en permanence les données de fonctionnement pour détecter les dérives naissantes et optimiser automatiquement les paramètres de cycle.
Les enjeux environnementaux orientent le développement vers des technologies plus respectueuses de l’environnement : récupération systématique de la chaleur des condensats, utilisation d’énergies renouvelables pour la génération de vapeur, optimisation des consommations d’eau par recyclage des condensats, réduction des émissions de gaz à effet de serre par amélioration des rendements énergétiques. Ces évolutions s’inscrivent dans les stratégies de développement durable des entreprises et les réglementations environnementales renforcées.
L’innovation dans les matériaux d’emballage et les nouveaux produits thérapeutiques (thérapies géniques, cellulaires, produits biologiques complexes) nécessite l’adaptation continue des technologies de stérilisation. Les autoclaves du futur devront traiter des charges de plus en plus diversifiées avec des exigences de préservation accrues, tout en maintenant leur efficacité microbicide et leur fiabilité opérationnelle.
La mondialisation des marchés impose une harmonisation croissante des standards techniques et réglementaires. Cette convergence internationale facilite les échanges commerciaux et simplifie la validation des processus pour les entreprises multinationales, tout en maintenant des niveaux de sécurité élevés et uniformes à l’échelle planétaire.
En conclusion, les autoclaves industriels continueront d’évoluer pour répondre aux défis futurs de la stérilisation industrielle : efficacité énergétique, intelligence embarquée, durabilité environnementale, flexibilité opérationnelle et excellence réglementaire. Ces technologies essentielles demeureront au cœur de la sécurité sanitaire et de l’innovation industrielle pour les décennies à venir.