Blog
DIFFÉRENCE ENTRE AUTOCLAVE ET STÉRILISATEUR : GUIDE TECHNIQUE COMPLET POUR LES PROFESSIONNELS DE SANTÉ

Figure 1 : Équipements de stérilisation dans un environnement hospitalier moderne
Table des Matières
- Introduction à la stérilisation médicale
- Définitions et concepts fondamentaux
- Les autoclaves : principe et fonctionnement
- Les stérilisateurs : variétés et applications
- Comparaison technique détaillée
- Paramètres critiques de stérilisation
- Applications spécialisées par domaine
- Critères de sélection d’équipement
- Maintenance et validation
- Réglementations et normes
- Technologies émergentes
- Analyse économique
- Perspectives d’avenir
- Conclusion
1. Introduction à la Stérilisation Médicale
La stérilisation représente l’un des piliers fondamentaux de la sécurité sanitaire dans tous les établissements de soins. Cette discipline scientifique et technique vise à éliminer ou détruire tous les micro-organismes vivants, y compris les bactéries, virus, champignons, parasites et spores bactériennes présents sur les dispositifs médicaux, instruments chirurgicaux et matériels réutilisables.
L’évolution historique de la stérilisation remonte aux travaux pionniers de Louis Pasteur et Joseph Lister au XIXe siècle, qui ont démontré l’importance de l’asepsie dans la prévention des infections nosocomiales. Aujourd’hui, les techniques de stérilisation constituent un écosystème complexe de technologies, de procédures et de contrôles qualité essentiels au fonctionnement sécurisé des systèmes de santé modernes.
Dans ce contexte technologique avancé, deux catégories d’équipements dominent le paysage de la stérilisation : les autoclaves et les stérilisateurs. Bien que ces termes soient parfois utilisés de manière interchangeable dans le langage courant, ils désignent des technologies distinctes avec des caractéristiques, des applications et des performances spécifiques.
Point clé : La compréhension précise des différences entre autoclaves et stérilisateurs est cruciale pour les professionnels de santé, car elle conditionne directement l’efficacité des processus de décontamination, la sécurité des patients et la conformité réglementaire des établissements.
Les enjeux contemporains de la stérilisation s’articulent autour de plusieurs défis majeurs : l’émergence de micro-organismes résistants, l’augmentation de la complexité des dispositifs médicaux, les exigences renforcées de traçabilité et de validation, ainsi que les contraintes économiques croissantes pesant sur les établissements de santé. Ces défis nécessitent une approche sophistiquée dans le choix et l’utilisation des technologies de stérilisation.
2. Définitions et Concepts Fondamentaux
2.1 Définition de l’Autoclave
L’autoclave, également appelé stérilisateur à vapeur d’eau, constitue un appareil de stérilisation utilisant la vapeur d’eau saturée sous pression comme agent stérilisant principal. Le terme « autoclave » provient du grec « autos » (soi-même) et du latin « clavis » (clé), faisant référence à son système d’auto-verrouillage sous pression.
Le principe physique de l’autoclave repose sur l’action combinée de trois paramètres critiques : la température élevée (généralement entre 121°C et 134°C), la pression saturante correspondante (entre 1,1 et 2,2 bars de surpression) et le temps d’exposition (variant de 15 minutes à plusieurs heures selon les applications). Cette synergie température-pression-temps assure la dénaturation irréversible des protéines microbiennes et la destruction des acides nucléiques.

Figure 2 : Gamme de stérilisateurs à vapeur pour applications médicales
2.2 Définition des Stérilisateurs
Le terme « stérilisateur » englobe une famille étendue d’appareils et de systèmes destinés à éliminer les micro-organismes par différentes méthodes physiques ou chimiques. Cette catégorie comprend non seulement les autoclaves, mais aussi les stérilisateurs à chaleur sèche, les systèmes de stérilisation par gaz (oxyde d’éthylène, peroxyde d’hydrogène vaporisé), les équipements de stérilisation par rayonnements ionisants, et les dispositifs de stérilisation par plasma.
Chaque type de stérilisateur présente des mécanismes d’action spécifiques adaptés à des catégories particulières de matériaux et d’applications. Cette diversité technologique permet de répondre aux exigences variées de stérilisation dans les différents secteurs de la santé, de la recherche et de l’industrie pharmaceutique.
2.3 Distinction Conceptuelle Fondamentale
La distinction principale entre autoclave et stérilisateur réside dans leur spécificité technologique. L’autoclave représente une technologie de stérilisation spécialisée utilisant exclusivement la vapeur d’eau sous pression, tandis que le stérilisateur constitue un terme générique englobant l’ensemble des technologies de stérilisation disponibles.
Attention : Cette distinction terminologique revêt une importance particulière dans les contextes réglementaires, normatifs et contractuels, où la précision des termes techniques conditionne la conformité des installations et des procédures.
3. Les Autoclaves : Principe et Fonctionnement Détaillé
3.1 Mécanismes Physico-Chimiques
Le fonctionnement de l’autoclave s’appuie sur les propriétés thermodynamiques de la vapeur d’eau saturée. Lorsque l’eau est portée à ébullition dans un environnement pressurisé, la température d’ébullition augmente proportionnellement à la pression selon la loi de Clausius-Clapeyron. Cette élévation de température permet d’atteindre des niveaux léthaux pour tous les micro-organismes, y compris les spores bactériennes les plus résistantes.
La vapeur d’eau présente des propriétés stérilisantes exceptionnelles grâce à sa capacité de pénétration et son coefficient de transfert thermique élevé. Contrairement à l’air chaud, la vapeur condensée libère instantanément sa chaleur latente de vaporisation (environ 2260 kJ/kg à 100°C), provoquant une élévation rapide et homogène de la température des matériaux à stériliser.
3.2 Cycles de Stérilisation Autoclave
3.2.1 Cycle Gravitaire (Gravity Displacement)
Le cycle gravitaire constitue la méthode la plus ancienne et la plus simple de stérilisation par autoclave. Dans ce système, la vapeur est introduite dans la chambre de stérilisation par le haut, tandis que l’air, plus dense, est évacué par le bas sous l’effet de la gravité. Ce processus de déplacement gravitaire nécessite un temps de purge prolongé pour assurer l’élimination complète de l’air résiduel.
Les paramètres types d’un cycle gravitaire incluent une température de 121°C, une pression de 1,1 bar (surpression) et une durée de stérilisation de 15 à 60 minutes selon la charge et la nature des matériaux. Ce cycle convient particulièrement aux liquides, milieux de culture et instruments non poreux sans cavités complexes.
3.2.2 Cycle à Vide Prélimaire (Pre-vacuum)
Le cycle à vide prélimaire représente une évolution technologique majeure permettant une élimination active de l’air par pompage sous vide avant l’introduction de la vapeur. Cette technique garantit une pénétration optimale de la vapeur dans les charges poreuses, les textiles et les instruments à géométrie complexe.
Le processus débute par une phase de vide poussé (généralement -0,8 à -0,95 bar), suivie de l’injection rapide de vapeur saturée. Cette méthode permet d’atteindre des températures de stérilisation plus élevées (134°C) avec des temps de cycle réduits (3 à 4 minutes de plateau de stérilisation), optimisant ainsi la productivité et réduisant l’exposition thermique des matériaux sensibles.
3.3 Types d’Autoclaves par Application
3.3.1 Autoclaves de Laboratoire
Les autoclaves de laboratoire, d’une capacité généralement comprise entre 20 et 200 litres, sont conçus pour la stérilisation de petites charges : milieux de culture, verrerie, instruments de laboratoire et déchets biologiques. Ces appareils privilégient la flexibilité des cycles et la précision des paramètres de stérilisation.

Figure 3 : Stérilisateur de laboratoire haute précision
3.3.2 Autoclaves Hospitaliers
Les autoclaves hospitaliers se caractérisent par leurs grandes capacités (300 à 1000 litres) et leurs systèmes de contrôle sophistiqués intégrant la traçabilité électronique, la validation automatique des cycles et les interfaces de gestion centralisée. Ces équipements traitent quotidiennement des volumes importants d’instruments chirurgicaux, textiles et dispositifs médicaux complexes.
3.3.3 Autoclaves Industriels
Dans le secteur pharmaceutique et biotechnologique, les autoclaves industriels atteignent des dimensions imposantes (plusieurs mètres cubes) et intègrent des systèmes de contrôle conformes aux bonnes pratiques de fabrication (BPF/GMP). Ces installations traitent les équipements de production, contenants et milieux de culture à grande échelle.
4. Les Stérilisateurs : Variétés et Applications Spécialisées
4.1 Stérilisateurs à Chaleur Sèche
Les stérilisateurs à chaleur sèche, également appelés fours Poupinel ou étuves de stérilisation, utilisent l’air chaud comme vecteur thermique pour la destruction des micro-organismes. Ces appareils fonctionnent selon deux principes : la convection naturelle (gravitaire) ou la convection forcée (ventilation).
La stérilisation par chaleur sèche nécessite des températures plus élevées (160°C à 180°C) et des temps d’exposition prolongés (1 à 4 heures) comparativement à l’autoclave. Cette exigence s’explique par l’efficacité thermique moindre de l’air sec par rapport à la vapeur d’eau saturée.

Figure 4 : Stérilisateur à chaleur sèche de précision pour laboratoire
4.1.1 Avantages de la Chaleur Sèche
La stérilisation par chaleur sèche présente des avantages spécifiques pour certaines catégories de matériaux. Elle convient parfaitement aux substances hydrophobes, poudres, huiles et instruments en acier carbone susceptibles de subir une corrosion par la vapeur d’eau. De plus, cette méthode n’implique aucun résidu chimique et permet la stérilisation d’emballages hermétiquement scellés.
4.1.2 Applications Spécialisées
Les domaines d’application privilégiés de la chaleur sèche incluent la stérilisation d’instruments d’optique de précision, d’électrodes métalliques, de poudres pharmaceutiques et de matériaux hydrophobes. En orthodontie et en joaillerie médicale, cette méthode préserve l’intégrité des alliages sensibles à l’humidité.
4.2 Stérilisateurs à Gaz
4.2.1 Stérilisation à l’Oxyde d’Éthylène
L’oxyde d’éthylène (EtO) constitue un agent stérilisant gazeux particulièrement efficace pour les dispositifs médicaux thermosensibles. Ce gaz alkylant agit par modification chimique des groupements fonctionnels des protéines et acides nucléiques microbiens, provoquant leur inactivation irréversible.
Les cycles de stérilisation à l’EtO s’effectuent généralement à des températures modérées (37°C à 63°C) avec des concentrations de gaz de 450 à 1200 mg/L et des durées pouvant atteindre plusieurs heures. Cette méthode nécessite des phases de dégazage prolongées (12 à 168 heures) pour éliminer les résidus toxiques.
4.2.2 Stérilisation au Peroxyde d’Hydrogène Vaporisé
La stérilisation par peroxyde d’hydrogène vaporisé (VHP) représente une alternative moderne à l’oxyde d’éthylène pour les matériaux thermosensibles. Ce procédé utilise la décomposition du peroxyde d’hydrogène en radicaux libres hautement réactifs (OH•) qui détruisent les structures cellulaires microbiennes.
Les avantages du VHP incluent l’absence de résidus toxiques (décomposition en eau et oxygène), des temps de cycle réduits (30 minutes à 3 heures) et une compatibilité avec de nombreux matériaux plastiques et électroniques.
4.3 Stérilisation par Plasma
La technologie de stérilisation par plasma utilise un champ électromagnétique pour ioniser le peroxyde d’hydrogène en phase gazeuse, créant un état de matière hautement énergétique contenant des espèces réactives (radicaux libres, ions, électrons). Ces espèces attaquent les composants vitaux des micro-organismes à basse température (45°C à 50°C).
Cette méthode convient particulièrement aux dispositifs médicaux sophistiqués intégrant des composants électroniques, optiques ou polymères sensibles. Les cycles de stérilisation plasma durent généralement 45 à 75 minutes, incluant les phases de conditionnement, stérilisation et aération.
4.4 Stérilisation par Rayonnements Ionisants
La stérilisation par rayonnements gamma, électrons accélérés ou rayons X constitue une méthode industrielle de choix pour la stérilisation de dispositifs médicaux à usage unique. Ces rayonnements de haute énergie provoquent la rupture des liaisons chimiques dans l’ADN microbien, entraînant la mort cellulaire.
Cette technique permet la stérilisation de produits déjà emballés dans leur conditionnement final, éliminant les risques de recontamination post-stérilisation. Les doses standard varient entre 15 et 50 kGy selon la résistance des micro-organismes cibles et la nature des matériaux traités.
5. Comparaison Technique Détaillée
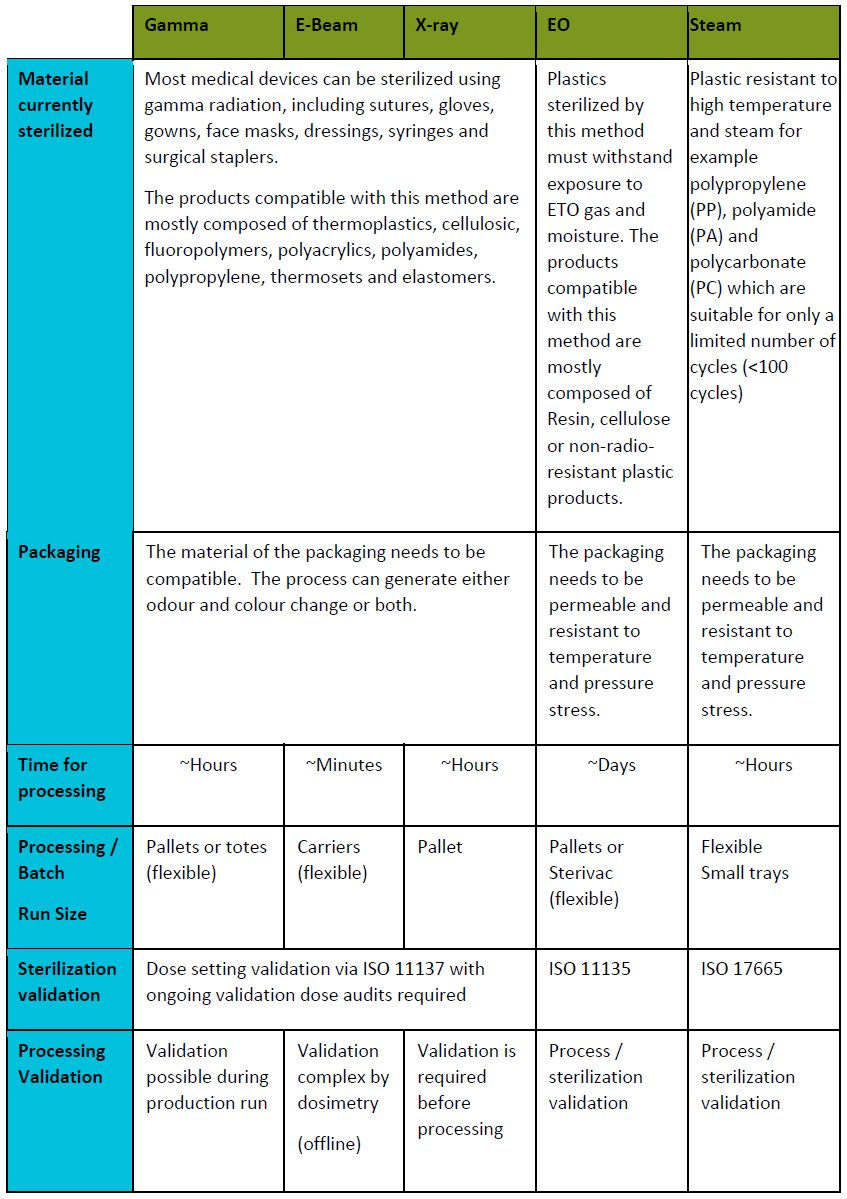
Figure 5 : Comparaison des différents procédés de stérilisation
5.1 Efficacité Microbicide Comparative
L’efficacité stérilisante varie significativement selon la méthode utilisée et les micro-organismes cibles. L’autoclave à vapeur d’eau présente une efficacité universelle contre tous les micro-organismes, y compris les prions selon certaines conditions spécialisées. Les spores de Geobacillus stearothermophilus constituent l’indicateur biologique de référence pour valider l’efficacité des cycles autoclave.
Les stérilisateurs à chaleur sèche démontrent également une efficacité complète mais nécessitent des conditions plus sévères. Les spores de Bacillus atrophaeus servent d’indicateur biologique pour cette méthode. La stérilisation gazeuse (EtO, VHP, plasma) présente une efficacité excellente contre la plupart des micro-organismes, avec des spécificités selon l’agent utilisé.
Tableau Comparatif d’Efficacité Microbicide
| Méthode de Stérilisation | Bactéries Végétatives | Spores Bactériennes | Virus | Champignons | Prions |
|---|---|---|---|---|---|
| Autoclave (121°C-134°C) | +++ | +++ | +++ | +++ | ++(134°C) |
| Chaleur Sèche (160°C-180°C) | +++ | +++ | +++ | +++ | ++ |
| Oxyde d’Éthylène | +++ | +++ | +++ | +++ | – |
| Peroxyde d’Hydrogène | +++ | +++ | +++ | +++ | – |
| Plasma | +++ | +++ | +++ | +++ | – |
Légende : +++ Très efficace, ++ Efficace sous conditions, + Efficacité limitée, – Inefficace
5.2 Compatibilité Matériaux
La compatibilité avec différents matériaux constitue un critère déterminant dans le choix de la méthode de stérilisation. L’autoclave présente une excellente compatibilité avec les métaux inoxydables, la verrerie borosilicatée et de nombreux plastiques thermorésistants (polypropylène, polycarbonate, PTFE). Cependant, certains matériaux sensibles à l’humidité ou à la température peuvent subir des altérations.
La chaleur sèche convient particulièrement aux matériaux hydrophobes et aux métaux sensibles à la corrosion, mais présente des limitations pour les plastiques thermosensibles. Les méthodes gazeuses offrent la plus grande polyvalence matériaux, permettant la stérilisation de dispositifs électroniques complexes et de polymères sensibles.
5.3 Temps de Cycle et Productivité
Les temps de cycle varient considérablement selon les méthodes de stérilisation. L’autoclave à vide prélimaire offre les cycles les plus rapides (30 à 60 minutes total) pour des charges standard. Les autoclaves gravitaires nécessitent des durées plus longues (1 à 3 heures) selon la nature et le volume des charges.
La stérilisation à chaleur sèche présente les cycles les plus longs (2 à 6 heures) en raison des temps de montée en température et des durées d’exposition prolongées. Les méthodes gazeuses proposent des compromis intéressants avec des cycles de 1 à 8 heures selon la technologie et les exigences de dégazage.
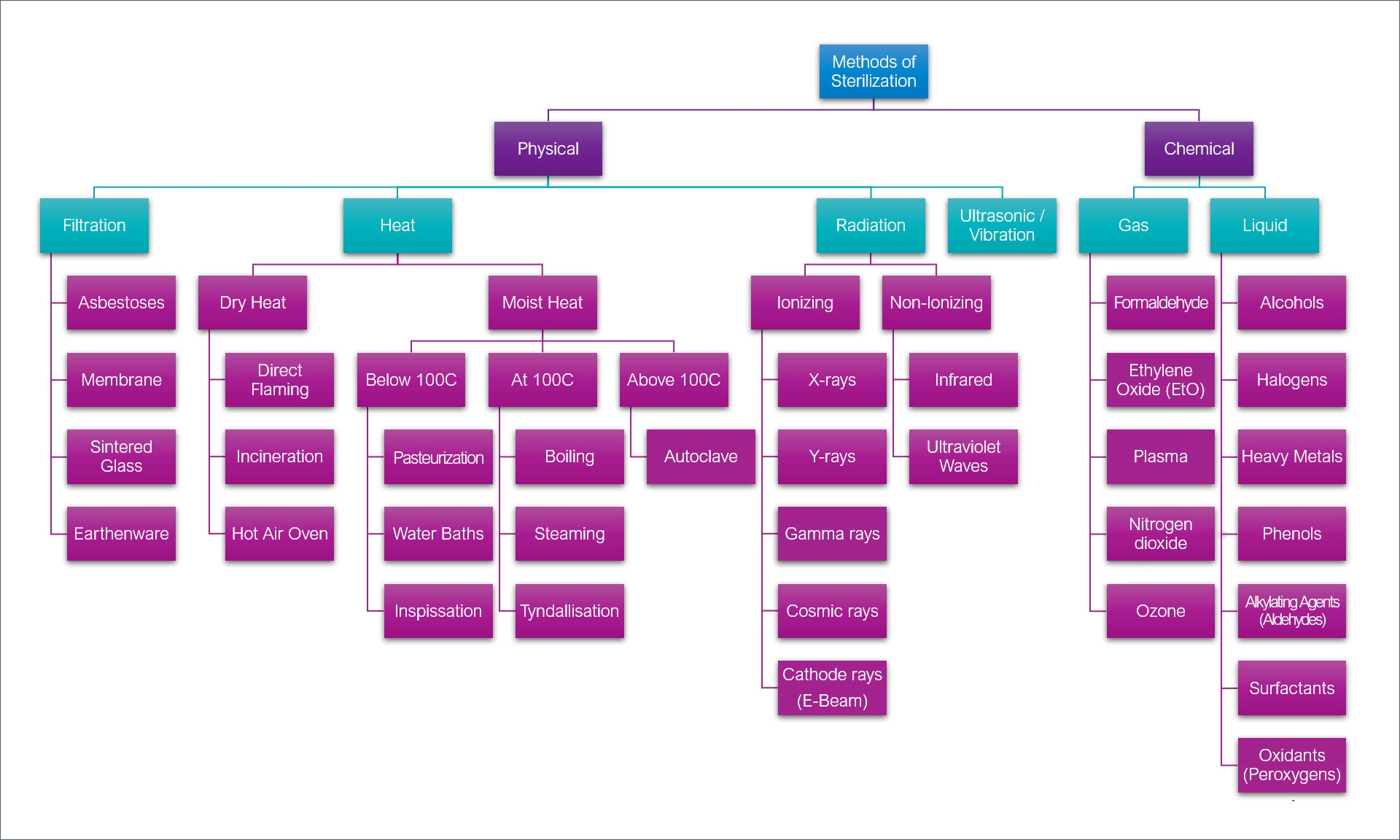
Figure 6 : Comparaison détaillée des méthodes de stérilisation et leur impact sur les matériaux
6. Paramètres Critiques de Stérilisation
6.1 Relation Température-Temps-Efficacité
La cinétique de destruction microbienne suit généralement une loi exponentielle décrite par l’équation de Chick-Watson : log N = log N₀ – kt, où N représente le nombre de micro-organismes survivants au temps t, N₀ le nombre initial, et k la constante de vitesse de destruction. Cette relation permet de calculer les valeurs D (temps de réduction décimale) et Z (variation de température pour un facteur 10 de variation de D).
Pour l’autoclave, les valeurs D₁₂₁°C des spores de Geobacillus stearothermophilus varient entre 1,5 et 3 minutes, avec une valeur Z typique de 7°C. Ces paramètres permettent de calculer les temps de stérilisation nécessaires pour atteindre un niveau d’assurance stérilité (SAL) donné, généralement fixé à 10⁻⁶ pour les dispositifs médicaux critiques.
6.2 Influence de l’Humidité et de la Pression
L’humidité joue un rôle fondamental dans l’efficacité de la stérilisation thermique. La présence d’eau facilite la dénaturation des protéines microbiennes en favorisant la rupture des liaisons hydrogène intramoléculaires. Cette synergie explique l’efficacité supérieure de la vapeur d’eau comparée à la chaleur sèche à température équivalente.
La pression en autoclave n’exerce pas d’effet stérilisant direct mais permet d’atteindre des températures élevées en maintenant l’eau à l’état liquide. La relation pression-température suit la courbe de vapeur saturante selon l’équation d’Antoine ou les tables thermodynamiques de l’eau.
6.3 Pénétration et Homogénéité
La pénétration de l’agent stérilisant constitue un paramètre critique déterminant l’efficacité du processus. La vapeur d’eau présente d’excellentes propriétés de pénétration dans les matériaux poreux et les emballages perméables, mais peut rencontrer des difficultés dans les volumes clos ou les instruments à géométrie complexe.
L’homogénéité de traitement nécessite une distribution uniforme de la température dans l’ensemble de la charge. Cette exigence impose des contraintes de chargement, de circulation et de positionnement des sondes de température pour assurer la validation des cycles.
6.4 Contrôle et Surveillance
Les systèmes modernes de stérilisation intègrent des dispositifs de contrôle sophistiqués permettant la surveillance en temps réel des paramètres critiques. Les enregistreurs électroniques multivoies documentent continuellement température, pression, vide et humidité avec une résolution temporelle élevée.
La validation physique s’accompagne d’indicateurs chimiques et biologiques fournissant une confirmation indépendante de l’efficacité du processus. Les intégrateurs chimiques modernes présentent des réponses calibrées équivalentes aux indicateurs biologiques pour certaines applications.
7. Applications Spécialisées par Domaine
7.1 Bloc Opératoire et Chirurgie
L’environnement chirurgical impose des exigences maximales de stérilité et de rapidité de traitement. Les autoclaves de bloc opératoire privilégient les cycles rapides à haute température (134°C, 3-4 minutes) pour permettre un retraitement d’urgence des instruments en cours d’intervention. Ces équipements intègrent des systèmes de séchage performants et des interfaces de traçabilité patient.
Les instruments complexes (endoscopes, robots chirurgicaux) nécessitent souvent des méthodes alternatives : stérilisation par plasma pour l’électronique sensible, ou désinfection de haut niveau par aldéhydes pour les équipements thermosensibles non implantables.
7.2 Laboratoires de Microbiologie
Les laboratoires de microbiologie utilisent principalement des autoclaves pour la stérilisation des milieux de culture, la décontamination des déchets biologiques et la préparation de matériel stérile. Les cycles gravitaires restent privilégiés pour les liquides et milieux gélosés, tandis que les cycles à vide préliminaire traitent les charges poreuses et les déchets solides.
La stérilisation à chaleur sèche trouve son application pour la verrerie de précision, les instruments métalliques et les substances thermostables sensibles à l’humidité. Les fours à convection forcée permettent d’optimiser l’homogénéité thermique et de réduire les durées de cycle.
7.3 Industrie Pharmaceutique
L’industrie pharmaceutique impose des contraintes réglementaires strictes (BPF/GMP) nécessitant la validation exhaustive des processus de stérilisation. Les autoclaves industriels intègrent des systèmes de contrôle 21 CFR Part 11 compliant avec signature électronique et audit trail complet.
La stérilisation terminale des produits finis privilégie l’autoclave pour les solutions injectables et les rayonnements ionisants pour les dispositifs médicaux. Les méthodes gazeuses (oxyde d’éthylène) traitent les composants thermosensibles des systèmes de production.
7.4 Médecine Vétérinaire
La médecine vétérinaire présente des défis spécifiques liés à la diversité des espèces traitées et aux contraintes économiques. Les autoclaves compacts de cabinet vétérinaire privilégient la polyvalence et la facilité d’utilisation pour traiter instruments chirurgicaux, textiles et matériel d’exploration.
Les établissements vétérinaires spécialisés adoptent des équipements plus sophistiqués incluant des systèmes de traçabilité adaptés aux exigences de certification qualité et aux contraintes d’audit réglementaire.
8. Critères de Sélection d’Équipement
8.1 Analyse des Besoins et Contraintes
La sélection d’un système de stérilisation nécessite une analyse préalable exhaustive des besoins spécifiques de l’établissement. Cette évaluation doit considérer le volume quotidien de charge, la nature des matériaux à traiter, les contraintes temporelles, les exigences réglementaires et les ressources disponibles (personnel, maintenance, consommables).
L’audit des pratiques existantes permet d’identifier les dysfonctionnements et d’optimiser les flux de retraitement. La cartographie des risques infectieux guide le choix des niveaux de stérilisation requis selon la classification des dispositifs médicaux (Spaulding).
8.2 Dimensionnement et Capacité
Le dimensionnement optimal d’un système de stérilisation résulte de l’équilibre entre la capacité nominale, la fréquence d’utilisation et les contraintes d’urgence. Le surdimensionnement entraîne des coûts d’investissement et d’exploitation excessifs, tandis que le sous-dimensionnement génère des goulots d’étranglement et des risques de sécurité.
Les calculs de dimensionnement intègrent les coefficients d’utilisation, les temps de cycle complets (incluant chargement, traitement et déchargement), les maintenances préventives et les pannes prévisibles. Une marge de sécurité de 20 à 30% constitue généralement une approche prudente.
8.3 Critères Technologiques
Les critères technologiques englobent la fiabilité des équipements, la performance énergétique, la facilité de maintenance et l’évolutivité des systèmes. La robustesse mécanique et la qualité des composants conditionnent la durée de vie opérationnelle et les coûts de maintenance préventive.
L’intégration des systèmes de gestion (GMAO, traçabilité, interfaces informatiques) devient cruciale dans les environnements hospitaliers modernes. La compatibilité avec les standards de communication (HL7, DICOM) facilite l’interopérabilité avec les systèmes d’information existants.
8.4 Aspects Économiques et ROI
L’analyse économique d’un investissement en stérilisation doit considérer le coût total de possession (TCO) incluant l’acquisition, l’installation, la formation, la maintenance, les consommables et les coûts de fin de vie. La comparaison doit intégrer les gains de productivité, la réduction des risques et l’amélioration de la qualité.
Le retour sur investissement (ROI) peut être calculé en considérant les économies générées : réduction des infections nosocomiales, optimisation des stocks d’instruments, amélioration de la rotation des équipements et diminution des coûts de sous-traitance.
Calcul ROI Simplifié :
ROI (%) = [(Gains annuels – Coûts annuels) / Investissement initial] × 100
Avec prise en compte sur la durée de vie économique de l’équipement (généralement 10-15 ans)
9. Maintenance et Validation
9.1 Maintenance Préventive Systématique
La maintenance préventive des systèmes de stérilisation constitue un impératif réglementaire et opérationnel garantissant la continuité de service et la sécurité des processus. Les programmes de maintenance doivent respecter les préconisations des fabricants tout en s’adaptant aux conditions d’utilisation spécifiques de chaque établissement.
Les interventions de maintenance préventive incluent la vérification des paramètres de fonctionnement, l’étalonnage des sondes et instruments de mesure, le remplacement des pièces d’usure et l’inspection des systèmes de sécurité. La fréquence de ces interventions varie selon l’intensité d’utilisation, généralement entre 3 et 12 mois.
9.2 Qualification et Validation
La validation des équipements de stérilisation suit une approche structurée en quatre phases : Qualification d’Installation (QI), Qualification Opérationnelle (QO), Qualification de Performance (QP) et Requalification périodique. Cette démarche assure la conformité initiale et maintient la fiabilité des processus dans le temps.
La Qualification d’Installation vérifie la conformité de l’installation aux spécifications : raccordements énergétiques, systèmes de sécurité, documentation technique. La Qualification Opérationnelle teste le fonctionnement de tous les systèmes dans les plages spécifiées. La Qualification de Performance démontre l’efficacité stérilisante avec des charges représentatives et des défis microbiologiques.
9.3 Contrôles de Routine et Surveillance
Les contrôles de routine assurent la surveillance continue de l’efficacité des processus de stérilisation. Ces contrôles combinent indicateurs physiques (enregistrement des paramètres), chimiques (tests Bowie-Dick, intégrateurs) et biologiques (spores test) selon une fréquence définie par l’analyse de risque.
Les tests de fuite vide, essentiels pour les autoclaves à vide préliminaire, détectent les défauts d’étanchéité compromettant l’efficacité des cycles. Ces tests doivent être effectués quotidiennement avec des critères d’acceptation stricts (généralement < 1,3 mbar/min).
9.4 Gestion de la Non-Conformité
La gestion des non-conformités nécessite des procédures rigoureuses de détection, analyse et correction. Toute défaillance du processus de stérilisation impose l’arrêt immédiat de l’équipement, l’isolement des charges traitées et l’investigation des causes racines.
L’analyse des défaillances peut révéler des dérives progressives nécessitant des ajustements préventifs ou des pannes brutales imposant des réparations d’urgence. La traçabilité complète des charges permet de gérer les rappels de matériel et d’évaluer l’impact sur la sécurité des patients.
10. Réglementations et Normes
10.1 Cadre Réglementaire Européen
La réglementation européenne des dispositifs médicaux (MDR 2017/745) impose des exigences strictes concernant la stérilisation des dispositifs médicaux. Cette réglementation établit des obligations de conformité pour les fabricants et utilisateurs, incluant la validation des processus, la surveillance post-commercialisation et la gestion des incidents.
La directive 93/42/CEE (remplacée par le MDR) et ses normes harmonisées définissent les exigences essentielles de sécurité et d’efficacité. Les organismes notifiés évaluent la conformité des systèmes qualité et des dossiers techniques avant délivrance du marquage CE.
10.2 Normes Internationales ISO
La série de normes ISO 17665 (stérilisation à la vapeur d’eau) constitue la référence internationale pour la validation et le contrôle de routine des autoclaves. Ces normes définissent les méthodologies de qualification, les critères d’acceptation et les exigences de documentation.
Les normes ISO 11135 (oxyde d’éthylène), ISO 11137 (irradiation) et ISO 14937 (méthodes générales) complètent le corpus normatif en couvrant l’ensemble des technologies de stérilisation. La norme ISO 14155 régit les essais cliniques de dispositifs médicaux incluant les aspects de stérilisation.
10.3 Pharmacopées et Guides BPF
Les pharmacopées européenne, américaine (USP) et japonaise établissent les standards de stérilisation pour les produits pharmaceutiques. Ces textes définissent les méthodes officielles de validation, les critères microbiologiques et les procédures de contrôle qualité.
Les guides BPF (Bonnes Pratiques de Fabrication) de l’EMA, FDA et ICH précisent les exigences applicables aux équipements de stérilisation dans l’industrie pharmaceutique. L’annexe 1 du guide européen traite spécifiquement de la fabrication de médicaments stériles.
10.4 Accréditation et Certification
L’accréditation ISO 15189 (laboratoires de biologie médicale) et ISO 17025 (laboratoires d’étalonnage et d’essais) impose des exigences spécifiques concernant la stérilisation des équipements et matériels. Ces référentiels exigent la validation documentée des processus et la traçabilité des opérations.
La certification des établissements de santé (HAS, JCI) intègre des critères d’évaluation de la stérilisation couvrant l’organisation, les procédures, la formation du personnel et la gestion des risques. Ces évaluations conditionnent l’autorisation d’activité et la contractualisation avec les organismes payeurs.
11. Technologies Émergentes et Innovations
11.1 Stérilisation par Plasma Atmosphérique
La technologie de plasma atmosphérique représente une innovation majeure permettant la stérilisation à température ambiante sans nécessiter de vide poussé. Cette méthode utilise des décharges électriques dans l’air ambiant pour générer des espèces réactives (ozone, radicaux hydroxyles, ions) capables de détruire les micro-organismes.
Les avantages incluent la rapidité des cycles (quelques minutes), l’absence de résidus toxiques et la compatibilité avec tous les matériaux. Cette technologie trouve des applications prometteuses pour la décontamination d’espaces confinés, d’équipements électroniques complexes et de dispositifs implantables sophistiqués.
11.2 Stérilisation par Lumière UV-C Pulsée
La stérilisation par lumière ultraviolette pulsée haute intensité constitue une méthode émergente exploitant les propriétés germicides du rayonnement UV-C (200-280 nm). Cette technologie délivre des impulsions de haute énergie (plusieurs joules par impulsion) capables de détruire instantanément les micro-organismes par altération de leur ADN.
Cette méthode présente l’avantage de la rapidité (quelques secondes d’exposition), de l’absence de résidus chimiques et de la possibilité de traitement de surfaces complexes. Les applications potentielles incluent la décontamination d’air, de surfaces et d’emballages dans l’industrie agroalimentaire et pharmaceutique.
11.3 Technologies Supercritiques
La stérilisation par fluides supercritiques (CO₂ supercritique additionné d’agents stérilisants) offre des perspectives intéressantes pour les matériaux ultra-sensibles. Cette technologie exploite les propriétés uniques des fluides supercritiques : densité liquide avec viscosité gazeuse, permettant une pénétration optimale dans les structures complexes.
Les conditions opératoires modérées (35-60°C, 74-300 bar) préservent l’intégrité des matériaux les plus sensibles tout en assurant une efficacité stérilisante comparable aux méthodes conventionnelles. Cette approche trouve des applications dans la stérilisation de biomatériaux, polymères biodégradables et dispositifs électroniques miniaturisés.
11.4 Intelligence Artificielle et Industrie 4.0
L’intégration de l’intelligence artificielle dans les systèmes de stérilisation révolutionne la surveillance prédictive et l’optimisation des processus. Les algorithmes d’apprentissage automatique analysent les données historiques pour prédire les pannes, optimiser les paramètres de cycle et personnaliser les traitements selon les charges.
Les objets connectés (IoT) permettent la surveillance à distance, la maintenance prédictive et l’intégration dans les écosystèmes hospitaliers numériques. La blockchain assure la traçabilité inaltérable des processus de stérilisation, renforçant la sécurité et la conformité réglementaire.
12. Analyse Économique Approfondie
12.1 Coûts d’Investissement et d’Exploitation
L’analyse économique des systèmes de stérilisation nécessite une approche globale intégrant tous les coûts directs et indirects sur la durée de vie de l’équipement. Les coûts d’investissement incluent l’acquisition de l’équipement, l’installation, les aménagements nécessaires (fluides, évacuations, ventilation) et la formation initiale du personnel.
Les coûts d’exploitation récurrents comprennent la maintenance préventive et curative, les consommables (eau, vapeur, produits chimiques, emballages), les contrôles qualité, l’énergie et les coûts de personnel. Ces postes représentent généralement 60 à 80% du coût total de possession sur 15 ans.
Répartition Typique des Coûts sur 15 ans
| Poste de Coût | Autoclave Standard | Stérilisateur Gaz | Stérilisateur Plasma |
|---|---|---|---|
| Investissement initial | 20-25% | 25-30% | 30-35% |
| Maintenance | 15-20% | 20-25% | 25-30% |
| Consommables | 25-30% | 30-35% | 20-25% |
| Énergie | 10-15% | 5-10% | 5-10% |
| Personnel | 25-30% | 15-20% | 15-20% |
12.2 Analyse Coût-Efficacité
L’analyse coût-efficacité compare les différentes technologies de stérilisation en rapportant les coûts totaux aux unités de charge traitées. Cette approche permet d’identifier la solution optimale selon le profil d’utilisation spécifique de chaque établissement.
Les autoclaves présentent généralement le meilleur ratio coût-efficacité pour les volumes importants de charges standard. Les technologies alternatives (gaz, plasma) deviennent compétitives pour les matériaux spécialisés ou les contraintes de temps de cycle. L’évaluation doit intégrer les coûts d’opportunité liés aux immobilisations d’instruments et aux retards opérationnels.
12.3 Impact des Réglementations sur les Coûts
L’évolution réglementaire génère des coûts additionnels significatifs : mise en conformité des installations existantes, renforcement des contrôles qualité, documentation étendue et formation continue du personnel. Ces coûts de conformité peuvent représenter 10 à 20% des coûts d’exploitation dans les environnements fortement régulés.
L’anticipation des évolutions réglementaires dans les choix d’investissement permet de minimiser les coûts de mise en conformité ultérieurs. La sélection d’équipements conformes aux standards les plus exigeants assure une meilleure pérennité des investissements.
12.4 Optimisation Économique
L’optimisation économique des processus de stérilisation passe par plusieurs leviers : mutualisation des équipements entre services, standardisation des procédures et matériels, optimisation des cycles et amélioration de la planification. La centralisation de la stérilisation permet généralement des économies d’échelle significatives.
L’externalisation de certaines activités de stérilisation peut présenter des avantages économiques pour les établissements de petite taille ou les charges spécialisées nécessitant des équipements coûteux. Cette approche doit être évaluée en considérant les risques logistiques et de dépendance.
13. Perspectives d’Avenir et Enjeux Émergents
13.1 Évolution Technologique
Les prochaines décennies verront probablement l’émergence de technologies de stérilisation révolutionnaires exploitant les nanotechnologies, la photonique avancée et les procédés biomimétiques. Les recherches actuelles explorent l’utilisation de nanoparticules catalytiques, de photosensibilisateurs et d’enzymes lytiques pour développer des méthodes de stérilisation ultra-rapides et ultra-efficaces.
La miniaturisation et la portabilité des équipements de stérilisation répondront aux besoins croissants de mobilité médicale, de soins à domicile et d’interventions en conditions extrêmes (militaire, spatial, humanitaire). Ces développements nécessiteront des innovations en matière de sources d’énergie, de contrôle automatisé et de validation rapide.
13.2 Défis Microbiologiques Émergents
L’émergence de micro-organismes multi-résistants et de nouvelles menaces infectieuses (prions atypiques, virus émergents) impose des défis croissants aux technologies de stérilisation. Le développement de biofilms résistants et de spores hyper-résistantes nécessite l’adaptation des protocoles et l’innovation technologique continue.
La compréhension approfondie des mécanismes de résistance microbienne guide le développement de stratégies de stérilisation combinées exploitant des modes d’action synergiques. L’approche multi-barrières intègre plusieurs technologies complémentaires pour assurer une sécurité maximale.
13.3 Intégration Numérique et Connectivité
La digitalisation complète des processus de stérilisation transforme la gestion des stérilisations centrales. Les systèmes intégrés de traçabilité RFID, la surveillance IoT en temps réel et l’analyse prédictive par intelligence artificielle optimisent les flux, réduisent les erreurs et améliorent la productivité.
La télésurveillance et la télémaintenance permettent l’expertise à distance, réduisant les coûts d’intervention et améliorant la disponibilité des équipements. La cybersécurité devient un enjeu critique nécessitant des architectures sécurisées et des protocoles de protection robustes.
13.4 Durabilité et Impact Environnemental
La pression environnementale croissante oriente le développement vers des technologies de stérilisation éco-responsables minimisant la consommation énergétique, les émissions et les déchets. L’économie circulaire appliquée à la stérilisation privilégie la réutilisation, le recyclage et la valorisation des sous-produits.
Les innovations en matière de récupération d’énergie, d’optimisation des cycles et de substitution des consommables polluants contribuent à réduire l’empreinte carbone des activités de stérilisation. L’éco-conception des équipements intègre ces contraintes dès la phase de développement.
14. Conclusion et Recommandations
L’analyse approfondie des différences entre autoclaves et stérilisateurs révèle la complexité et la richesse de ce domaine technologique essentiel à la sécurité sanitaire. Cette étude démontre que le terme « autoclave » désigne spécifiquement les appareils de stérilisation par vapeur d’eau sous pression, tandis que « stérilisateur » englobe l’ensemble des technologies de décontamination microbienne.
Les autoclaves conservent leur position dominante grâce à leur efficacité universelle, leur rapidité d’action et leur excellent rapport coût-efficacité. Cependant, l’évolution des dispositifs médicaux vers une complexité croissante et l’intégration de matériaux sensibles nécessitent le recours à des technologies alternatives spécialisées.
14.1 Recommandations pour les Professionnels
Les professionnels de santé et responsables d’équipements biomédicaux doivent adopter une approche structurée dans le choix des technologies de stérilisation. Cette démarche doit intégrer l’analyse des besoins spécifiques, l’évaluation des contraintes techniques et réglementaires, et l’optimisation économique sur le cycle de vie complet.
La formation continue du personnel constitue un investissement essentiel garantissant la maîtrise des technologies et l’adaptation aux évolutions réglementaires. La mise en place de programmes de formation structurés, d’évaluations périodiques des compétences et de veille technologique assure la maintien d’un niveau d’expertise optimal.
14.2 Orientations Stratégiques
Les établissements de santé doivent développer des stratégies de stérilisation cohérentes avec leurs orientations stratégiques globales. La centralisation versus décentralisation, l’externalisation sélective, l’investissement technologique et la mutualisation inter-établissements constituent des leviers d’optimisation importants.
L’anticipation des évolutions technologiques et réglementaires guide les choix d’investissement à moyen et long terme. La flexibilité et l’évolutivité des installations permettent l’adaptation aux changements futurs sans remise en cause fondamentale des équipements.
14.3 Enjeux de Recherche et Développement
La recherche future en stérilisation doit privilégier le développement de technologies durables, efficaces et économiquement viables. Les axes prioritaires incluent les méthodes de stérilisation rapide, les technologies respectueuses de l’environnement et les systèmes adaptatifs intelligents.
La collaboration entre industriels, centres de recherche et utilisateurs finaux favorise l’innovation orientée vers les besoins réels. Les programmes de recherche collaborative européens et internationaux accélèrent le transfert technologique et l’harmonisation des standards.
Message clé : La maîtrise des technologies de stérilisation constitue un enjeu stratégique majeur pour la qualité et la sécurité des soins. La compréhension approfondie des différences entre autoclaves et stérilisateurs guide les choix technologiques optimaux et assure la conformité aux exigences les plus exigeantes.
En conclusion, l’évolution rapide du paysage technologique de la stérilisation nécessite une veille active et une adaptation continue des pratiques professionnelles. L’investissement dans la formation, la technologie et l’organisation constitue la clé du succès dans ce domaine critique pour la santé publique.
Cette analyse technique approfondie fournit aux professionnels les éléments nécessaires pour naviguer avec efficacité dans la complexité des choix technologiques et assurer l’excellence opérationnelle de leurs activités de stérilisation. L’avenir de la stérilisation s’annonce riche en innovations prometteuses au service de la sécurité des patients et de l’efficience des systèmes de santé.
