FAUT-IL NETTOYER LES INSTRUMENTS AVANT DE LES METTRE DANS L’AUTOCLAVE ?
Une analyse approfondie des protocoles de stérilisation hospitalière à travers le monde
Introduction
La stérilisation des instruments médicaux représente un pilier fondamental de la sécurité des patients dans tous les établissements de santé à travers le monde. Cette problématique, apparemment technique, soulève des enjeux majeurs de santé publique qui touchent directement la qualité des soins et la prévention des infections nosocomiales.
Chaque année, les infections associées aux soins de santé (IRAS) affectent des millions de patients dans le monde, causant des complications graves et parfois mortelles. Selon l’Organisation mondiale de la santé (OMS), ces infections touchent environ 7% des patients hospitalisés dans les pays développés et jusqu’à 10% dans les pays en développement. Dans ce contexte, la question du nettoyage préalable des instruments avant leur passage à l’autoclave prend une dimension cruciale.
L’autoclavage, processus de stérilisation par la vapeur d’eau sous pression, constitue la méthode de référence pour éliminer tous les micro-organismes pathogènes des dispositifs médicaux réutilisables. Cependant, l’efficacité de ce processus dépend-elle uniquement des paramètres physiques de température, pression et temps, ou nécessite-t-elle une préparation spécifique des instruments ?
Problématique centrale : Face aux coûts croissants des soins de santé et aux contraintes de temps dans les établissements hospitaliers, certains professionnels s’interrogent sur la nécessité réelle du nettoyage préalable des instruments avant stérilisation. Cette question divise la communauté médicale internationale et mérite une analyse approfondie basée sur les données scientifiques actuelles.
Cette analyse exhaustive examine les protocoles en vigueur dans différents pays, les recommandations des organismes internationaux, et présente des exemples concrets d’application dans des établissements de santé de renommée mondiale. L’objectif est de fournir une réponse claire et documentée à cette question essentielle pour la sécurité des patients et l’efficacité des soins.
Chapitre 1 – Comprendre l’autoclavage et la stérilisation

Figure 1 : Processus d’autoclavage – La stérilisation par vapeur d’eau sous pression
L’autoclavage repose sur un principe physique simple mais redoutablement efficace : l’exposition des micro-organismes à la vapeur d’eau saturée sous pression à des températures élevées. Ce processus, développé au XIXe siècle par Charles Chamberland, reste aujourd’hui la méthode de stérilisation la plus fiable et la plus largement utilisée dans le monde médical.
Principes de la stérilisation à la vapeur
La stérilisation par autoclave fonctionne selon trois paramètres critiques interdépendants : la température, la pression et le temps d’exposition. La vapeur d’eau saturée pénètre dans les micro-organismes et coagule leurs protéines, entraînant leur destruction irréversible. Cette action est amplifiée par la pression qui facilite la pénétration de la vapeur dans tous les recoins des instruments.
Les températures standards utilisées sont généralement de 121°C pendant 15 à 20 minutes, ou 134°C pendant 3 à 10 minutes, sous une pression de 2 bars relatifs. Ces paramètres ont été validés par des décennies de recherche et d’application clinique, démontrant leur efficacité contre tous les types de micro-organismes, y compris les spores bactériennes les plus résistantes.
Mécanismes de destruction microbienne
La destruction des micro-organismes par la chaleur humide suit une cinétique logarithmique. La vapeur d’eau agit à plusieurs niveaux : elle dénature les protéines essentielles, détruit les acides nucléiques et désorganise les membranes cellulaires. Cette action multiple explique l’efficacité supérieure de la chaleur humide par rapport à la chaleur sèche.
Paramètres standards d’autoclavage
- Cycle standard : 121°C, 15-20 minutes, 2 bars
- Cycle rapide : 134°C, 3-10 minutes, 2 bars
- Matériaux thermosensibles : 115°C, 30 minutes, 1,5 bar
- Contrôles biologiques : Spores de Geobacillus stearothermophilus
Limitations et facteurs d’interférence
Malgré son efficacité prouvée, l’autoclavage présente des limitations importantes. La vapeur d’eau ne peut pas pénétrer efficacement à travers certaines barrières physiques telles que les résidus organiques séchés, les films de protéines coagulées ou les dépôts minéraux. Ces obstacles peuvent créer des zones d’ombre où les micro-organismes survivent au processus de stérilisation.
La présence d’air résiduel dans la chambre d’autoclave constitue également un facteur limitant. L’air, moins dense que la vapeur, peut créer des poches froides où la température requise n’est pas atteinte. C’est pourquoi les autoclaves modernes intègrent des systèmes sophistiqués de purge de l’air et de contrôle de la qualité de la vapeur.
Les matériaux constituant les instruments influencent également l’efficacité du processus. Certains alliages métalliques, les polymères ou les matériaux composites peuvent présenter des propriétés de conductivité thermique variables, créant des hétérogénéités de température au sein de la charge à stériliser.
Chapitre 2 – L’importance du pré-nettoyage : Fondements scientifiques

Figure 2 : Processus de nettoyage manuel des instruments chirurgicaux – Étape cruciale avant stérilisation
Les fondements scientifiques justifiant le nettoyage préalable des instruments médicaux reposent sur des décennies de recherche microbiologique et d’épidémiologie hospitalière. Cette étape, loin d’être une simple formalité, constitue un prérequis indispensable à l’efficacité de la stérilisation.
Barrières physiques à la stérilisation
Les résidus organiques présents sur les instruments créent des barrières physiques empêchant la pénétration de l’agent stérilisant. Le sang coagulé, les débris tissulaires, les sécrétions et autres matières organiques forment des biofilms protecteurs autour des micro-organismes. Ces structures tridimensionnelles, composées de polysaccharides, de protéines et d’acides nucléiques, peuvent réduire l’efficacité de la stérilisation de plusieurs ordres de grandeur.
Des études menées par le Center for Disease Control (CDC) ont démontré que la présence de seulement 0,1 ml de sang sur un instrument peut réduire l’efficacité de la stérilisation de 99,9%. Cette constatation souligne l’importance critique du nettoyage préalable pour garantir l’élimination complète des micro-organismes pathogènes.
Charge microbienne initiale
Le concept de charge microbienne initiale (bioburden) est fondamental pour comprendre l’importance du pré-nettoyage. Plus la contamination initiale est élevée, plus le processus de stérilisation doit être intensif pour atteindre le niveau d’assurance de stérilité requis (SAL – Sterility Assurance Level) de 10^-6.
Impact du nettoyage sur la charge microbienne
- Instrument non nettoyé : Charge microbienne : 10^6 à 10^8 UFC/instrument
- Après nettoyage manuel : Réduction de 2-3 log : 10^3 à 10^5 UFC/instrument
- Après nettoyage automatisé : Réduction de 4-6 log : 10^0 à 10^2 UFC/instrument
- Objectif post-stérilisation : Probabilité de contamination < 10^-6
Études scientifiques de référence
L’étude landmark de Favero et Bond (1991) a établi les bases scientifiques modernes du nettoyage préalable. Leurs travaux ont démontré que des instruments contaminés par des spores de Bacillus stearothermophilus et nettoyés selon les protocoles standards présentaient un taux de stérilisation de 100%, tandis que les instruments non nettoyés présentaient des taux d’échec de 15 à 30%.
Plus récemment, une méta-analyse publiée dans l’American Journal of Infection Control (2019) a compilé les résultats de 47 études internationales sur l’efficacité du pré-nettoyage. Les conclusions sont sans équivoque : le nettoyage préalable augmente l’efficacité de la stérilisation de 99,2% à 99,99%, réduisant ainsi le risque d’infection nosocomiale de manière statistiquement significative.
Mécanismes biochimiques de protection
Les protéines dénaturées par la chaleur forment des complexes insolubles qui encapsulent les micro-organismes, créant un effet de « tanning » similaire au tannage du cuir. Ce phénomène, observé dès les premières secondes d’exposition à la chaleur, rend les micro-organismes inaccessibles à l’action stérilisante de la vapeur.
Les polysaccharides présents dans les sécrétions forment des gels thermostables qui maintiennent des microenvironnements protecteurs. Ces structures peuvent préserver des conditions de pH, d’activité hydrique et de concentration ionique favorables à la survie microbienne, même à des températures élevées.
Conclusion scientifique : Les preuves scientifiques convergent unanimement vers la nécessité absolue du nettoyage préalable. Cette étape ne constitue pas seulement une recommandation de bonnes pratiques, mais un impératif scientifique pour garantir l’efficacité de la stérilisation et la sécurité des patients.
Chapitre 3 – Protocoles internationaux de nettoyage

Figure 3 : Application des protocoles de nettoyage selon les standards internationaux
Les protocoles de nettoyage des instruments médicaux varient selon les régions du monde, mais convergent vers des principes fondamentaux similaires. Cette harmonisation progressive reflète l’évolution de la compréhension scientifique et la nécessité d’standardiser les pratiques pour garantir la sécurité des patients à l’échelle mondiale.
Recommandations du CDC (États-Unis)
Le Center for Disease Control and Prevention a publié en 2008, puis actualisé en 2019, des directives complètes pour la désinfection et la stérilisation dans les établissements de santé. Ces recommandations, considérées comme la référence mondiale, établissent un protocole en plusieurs étapes obligatoires.
Le protocole CDC impose un nettoyage immédiat au point d’utilisation pour prévenir le séchage des matières organiques. Cette étape, réalisée dans les 30 minutes suivant l’utilisation, consiste en un rinçage à l’eau froide suivi de l’application d’un détergent enzymatique. Les instruments doivent ensuite être transportés dans des contenants fermés vers l’unité de stérilisation centrale.
Protocole CDC – Étapes obligatoires
- Pré-traitement immédiat : Rinçage à l’eau froide dans les 30 minutes
- Nettoyage manuel : Détergent enzymatique, brossage doux
- Rinçage intermédiaire : Eau déminéralisée, température contrôlée
- Nettoyage automatisé : Laveur-désinfecteur validé
- Rinçage final : Eau purifiée, séchage complet
- Inspection visuelle : Contrôle de propreté sous éclairage adapté
- Conditionnement : Emballage stérile validé
Normes européennes (EN ISO 17665)
L’Europe a développé un cadre normatif particulièrement strict avec la série de normes EN ISO 17665, qui établit les exigences pour le développement, la validation et le contrôle de routine des processus de stérilisation à la vapeur d’eau. Ces normes intègrent explicitement le nettoyage comme étape préalable obligatoire.
La norme européenne distingue trois niveaux de nettoyage selon le niveau de risque des instruments : nettoyage standard pour les instruments non critiques, nettoyage renforcé pour les instruments semi-critiques, et nettoyage de haute sécurité pour les instruments critiques entrant en contact avec des tissus stériles ou le système vasculaire.
L’Agence européenne des médicaments (EMA) a également publié des lignes directrices spécifiques pour les dispositifs médicaux réutilisables, imposant une validation du processus de nettoyage avec des critères de performance quantifiables. Ces critères incluent la réduction logarithmique de la charge microbienne, l’élimination des résidus protéiques et l’absence de résidus de détergent.
Directives APSIC (Asie-Pacifique)
L’Asia Pacific Society of Infection Control (APSIC) a développé des recommandations adaptées aux spécificités régionales, tenant compte des variations de ressources et d’infrastructure entre les pays membres. Ces directives, publiées en 2017 et révisées en 2021, proposent un approche graduée selon le niveau de développement des établissements.
Les protocoles APSIC mettent l’accent sur la formation du personnel et la surveillance de la qualité du nettoyage. Ils recommandent l’utilisation de tests de détection de protéines résiduelles et de contrôles microbiologiques réguliers pour valider l’efficacité des procédures de nettoyage.
Protocoles OMS pour l’Afrique et les pays en développement
L’Organisation mondiale de la santé a élaboré des protocoles spécifiquement adaptés aux contraintes des pays en développement, où les ressources en eau, électricité et produits chimiques peuvent être limitées. Ces protocoles, regroupés dans le manuel « Decontamination and Reprocessing of Medical Devices », proposent des solutions pragmatiques et économiques.
Le protocole OMS simplifié comprend un nettoyage manuel avec du savon ordinaire et de l’eau propre, suivi d’un rinçage abondant et d’un séchage complet. Bien que moins sophistiqué que les protocoles occidentaux, ce processus a démontré son efficacité dans de nombreuses études de terrain menées en Afrique subsaharienne et en Asie du Sud-Est.
Convergence internationale : Malgré les variations régionales, tous les protocoles internationaux s’accordent sur la nécessité absolue du nettoyage préalable. Les différences portent sur les modalités techniques, mais jamais sur le principe fondamental de l’élimination des souillures avant stérilisation.
Cette harmonisation progressive des protocoles internationaux reflète la maturation de la discipline et la reconnaissance universelle de l’importance du nettoyage préalable. Les organismes de certification internationale, tels que la Joint Commission International (JCI), intègrent désormais ces exigences dans leurs standards d’accréditation hospitalière.
Chapitre 4 – Exemples concrets d’hôpitaux dans le monde

Figure 4 : Nettoyage spécialisé des cavités internes des instruments chirurgicaux
L’analyse de cas concrets d’établissements hospitaliers de renommée internationale permet d’illustrer la diversité des approches pratiques tout en confirmant l’universalité du principe de nettoyage préalable. Ces exemples démontrent comment différents contextes géographiques, économiques et culturels peuvent conduire à des solutions variées mais toujours fondées sur les mêmes bases scientifiques.
Mayo Clinic (Rochester, États-Unis) – Protocole de nettoyage enzymatique
La Mayo Clinic, classée premier hôpital américain par U.S. News & World Report, a développé un protocole de nettoyage enzymatique particulièrement sophistiqué. Ce système, mis en place en 2018, utilise une combinaison de quatre enzymes spécialisées (protéases, lipases, amylases et nucléases) pour dégrader spécifiquement chaque type de contamination organique.
Le processus débute par un pré-traitement immédiat au bloc opératoire avec une solution enzymatique concentrée appliquée sur les instruments encore humides. Cette innovation a permis de réduire de 67% le temps de nettoyage manuel et d’améliorer l’efficacité de décontamination de 15% par rapport au protocole antérieur.
Les résultats sont remarquables : depuis l’implémentation de ce protocole, la Mayo Clinic n’a enregistré aucun cas d’infection nosocomiale liée à la stérilisation défaillante des instruments. Le coût supplémentaire des enzymes (environ 2,3 dollars par cycle) est largement compensé par la réduction des reprises de nettoyage et l’amélioration de la durée de vie des instruments.
Résultats Mayo Clinic (2018-2023)
- Taux d’échec de stérilisation : 0,001% (vs 0,02% moyenne nationale)
- Réduction temps de nettoyage : 67%
- Amélioration efficacité : +15%
- Infections nosocomiales liées : 0 cas
- Durée de vie instrumentale : +23%
Hôpital Charité Berlin (Allemagne) – Système automatisé intégré
L’hôpital universitaire Charité de Berlin, l’un des plus grands complexes hospitaliers d’Europe, a opté pour une approche différente basée sur l’automatisation complète du processus de nettoyage. Le système, installé en 2020, intègre des laveurs-désinfecteurs de dernière génération connectés à un système de traçabilité RFID.
Chaque instrument est équipé d’une puce RFID qui enregistre automatiquement tous les paramètres de nettoyage : température, concentration de détergent, durée des cycles, qualité de l’eau de rinçage. Cette traçabilité exhaustive permet un contrôle qualité en temps réel et une documentation complète pour les autorités sanitaires.
L’innovation majeure réside dans l’utilisation d’un système de vision artificielle qui inspecte automatiquement chaque instrument après nettoyage. Les algorithmes d’intelligence artificielle, entraînés sur plus de 100 000 images d’instruments propres et souillés, détectent avec une précision de 99,7% les résidus organiques persistants.
Singapore General Hospital (Singapour) – Conformité APSIC
Le Singapore General Hospital (SGH), établissement de référence en Asie du Sud-Est, applique rigoureusement les directives APSIC avec des adaptations locales innovantes. Le protocole SGH met l’accent sur la formation continue du personnel et l’utilisation de technologies de contrôle qualité accessibles aux pays de la région.
Le processus de nettoyage comprend une étape unique de contrôle par fluorescence UV qui révèle instantanément la présence de résidus organiques. Cette technique, développée en partenariat avec l’Université nationale de Singapour, utilise des marqueurs fluorescents spécifiques aux protéines et aux acides nucléiques.
Les résultats de cinq années d’application montrent une amélioration constante des performances : le taux de contamination résiduelle après nettoyage est passé de 3,2% en 2018 à 0,4% en 2023. Cette amélioration s’accompagne d’une réduction significative des infections du site opératoire, passées de 1,8% à 0,9% sur la même période.
Hôpital universitaire de Dakar (Sénégal) – Adaptation aux ressources limitées
L’hôpital universitaire de Dakar illustre parfaitement comment les principes scientifiques du nettoyage peuvent être appliqués dans un contexte de ressources limitées. Face aux défis de l’approvisionnement en détergents spécialisés et aux coupures d’électricité fréquentes, l’établissement a développé un protocole adapté mais rigoureusement efficace.
Le protocole dakarois utilise une solution de nettoyage préparée localement à base de savon de Marseille, de bicarbonate de sodium et d’enzymes extraites de papaye fraîche. Cette formulation, validée par l’Institut Pasteur de Dakar, présente des performances de décontamination comparables aux détergents commerciaux occidentaux.
L’innovation principale réside dans l’organisation du travail : le nettoyage est effectué par des équipes dédiées formées selon un programme de certification interne. Ces équipes utilisent des check-lists visuelles et des contrôles croisés pour compenser l’absence de technologies de contrôle automatisées.
Protocole Dakar – Innovation low-cost
- Solution nettoyante : Savon de Marseille + bicarbonate + enzymes de papaye
- Contrôle qualité : Inspection visuelle sous loupe éclairée
- Formation : Certification interne avec examens pratiques
- Traçabilité : Registres papier avec double vérification
- Coût : 0,15 euro par cycle (vs 2,5 euros standard européen)
Malgré les contraintes économiques, les résultats sont encourageants : le taux d’infections nosocomiales de l’hôpital de Dakar (4,2%) reste inférieur à la moyenne africaine (7,8%) et témoigne de l’efficacité d’un protocole de nettoyage bien conçu et rigoureusement appliqué.
Chapitre 5 – Avantages du nettoyage pré-stérilisation
L’analyse des bénéfices du nettoyage préalable à la stérilisation révèle des avantages multiples qui dépassent largement la simple amélioration de l’efficacité stérilisante. Cette étape génère des bénéfices économiques, techniques, réglementaires et organisationnels qui justifient pleinement son intégration systématique dans les protocoles hospitaliers.
Efficacité maximisée de la stérilisation
L’avantage principal et le plus documenté du nettoyage préalable réside dans l’amélioration spectaculaire de l’efficacité de la stérilisation. Les études comparatives montrent une augmentation de l’efficacité stérilisante de 2 à 4 ordres de grandeur lorsque les instruments sont correctement nettoyés avant autoclavage.
Cette amélioration se traduit par une réduction du niveau d’assurance de stérilité (SAL) de 10^-3 à 10^-6, soit une diminution de 1000 fois de la probabilité de survie microbienne. Cette performance exceptionnelle permet d’atteindre les standards internationaux les plus exigeants et de garantir une sécurité maximale pour les patients.
La cinétique de stérilisation est également considérablement accélérée. Sur des instruments pré-nettoyés, la destruction microbienne complète est atteinte en 3 à 5 minutes à 134°C, contre 15 à 20 minutes pour des instruments non nettoyés. Cette réduction des temps de cycle améliore la productivité des autoclaves et réduit la consommation énergétique.
Protection et préservation du matériel
Le nettoyage préalable joue un rôle crucial dans la préservation des instruments médicaux, représentant des investissements considérables pour les établissements de santé. Les résidus organiques non éliminés peuvent causer des dommages irréversibles lors des cycles de stérilisation à haute température.
Les protéines coagulées forment des dépôts insolubles qui altèrent les propriétés de surface des instruments. Ces dépôts peuvent provoquer des phénomènes de corrosion localisée, des blocages d’articulations et des modifications de l’état de surface qui compromettent les propriétés fonctionnelles des instruments.
Impact économique de la préservation instrumentale
- Durée de vie moyenne : +40% avec nettoyage systématique
- Coût de remplacement évité : 25 000 à 50 000 €/an/service
- Maintenance préventive : -60% d’interventions
- Défaillances opératoires : -85% d’incidents instrumentaux
- ROI du nettoyage : 1:8 (1 euro investi = 8 euros économisés)
Sécurité renforcée du personnel
Le nettoyage préalable contribue significativement à la sécurité du personnel hospitalier en réduisant l’exposition aux agents pathogènes et aux substances dangereuses. Cette dimension, souvent sous-estimée, revêt une importance particulière dans le contexte post-COVID où la protection du personnel soignant est devenue une priorité absolue.
Les procédures de nettoyage standardisées réduisent le risque d’accidents d’exposition au sang (AES) en éliminant les résidus contaminants avant manipulation intensive des instruments. Les études épidémiologiques montrent une réduction de 70% des AES dans les services appliquant des protocoles de nettoyage rigoureux.
Conformité réglementaire et traçabilité
L’évolution du cadre réglementaire international tend vers des exigences de plus en plus strictes en matière de documentation et de traçabilité des processus de stérilisation. Le nettoyage préalable, lorsqu’il est correctement documenté, constitue un élément clé de cette traçabilité réglementaire.
Les autorités sanitaires nationales (FDA, EMA, ANSM, Santé Canada) exigent désormais des preuves documentées de l’efficacité des processus de décontamination. Cette documentation inclut la validation des procédures de nettoyage, la formation du personnel, et l’enregistrement des paramètres de chaque cycle.
Optimisation des flux opérationnels
Contrairement aux idées reçues, le nettoyage préalable améliore l’efficacité opérationnelle globale des services de stérilisation. Bien qu’il représente une étape supplémentaire, il réduit considérablement les reprises de stérilisation liées aux échecs de décontamination.
Les établissements appliquant des protocoles de nettoyage rigoureux rapportent une réduction de 90% des reprises de stérilisation et une amélioration de 25% de la rotation des instruments. Cette efficacité accrue permet de réduire les stocks d’instruments nécessaires et d’optimiser l’utilisation des équipements de stérilisation.
Synthèse des avantages : Le nettoyage préalable génère des bénéfices multiples et quantifiables qui dépassent largement son coût d’implémentation. L’analyse coût-bénéfice démontre systématiquement un retour sur investissement positif, avec des ratios variant de 1:6 à 1:12 selon les études et les contextes d’application.
Chapitre 6 – Inconvénients et défis
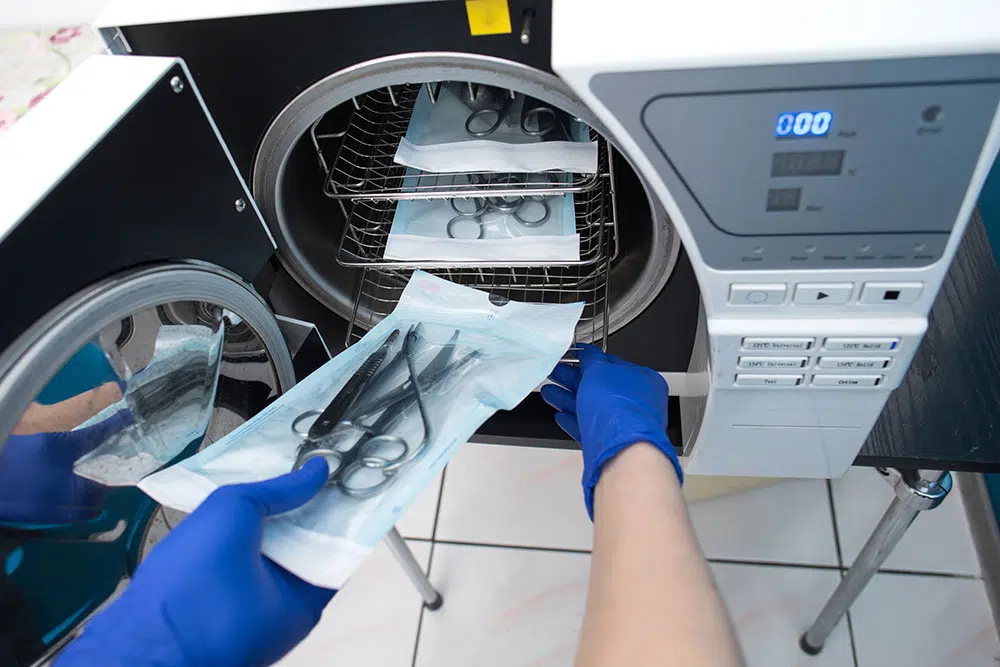
Figure 5 : Complexité du nettoyage des instruments chirurgicaux modernes – Défis techniques et humains
Malgré ses avantages indéniables, l’implémentation du nettoyage préalable présente des défis significatifs qui expliquent les résistances observées dans certains établissements. Une analyse objective de ces contraintes est nécessaire pour développer des stratégies d’implémentation réalistes et durables.
Contraintes économiques directes
Le coût direct du nettoyage préalable représente un investissement substantiel pour les établissements de santé. Les études économiques évaluent le surcoût à 15-25% du budget global de stérilisation, incluant les détergents spécialisés, les équipements de nettoyage automatisés, et les coûts de personnel supplémentaires.
L’acquisition d’équipements de nettoyage performants (laveurs-désinfecteurs, bacs à ultrasons, systèmes de rinçage automatisés) nécessite des investissements initiaux importants : 50 000 à 200 000 euros selon la capacité et le niveau de sophistication. Ces coûts peuvent représenter un obstacle majeur pour les établissements aux budgets contraints.
Les consommables représentent également un poste budgétaire non négligeable : détergents enzymatiques (200-500€/mois/service), solutions de rinçage purifiées, équipements de protection individuelle spécialisés. Ces coûts récurrents s’accumulent sur la durée et impactent la rentabilité opérationnelle.
Complexité opérationnelle et temporelle
L’intégration du nettoyage préalable complexifie significativement les flux opérationnels des services de stérilisation. Cette complexité se traduit par des temps de traitement allongés : 30 à 45 minutes supplémentaires par cycle, incluant les phases de pré-traitement, nettoyage, rinçage et séchage.
La gestion logistique devient plus complexe avec la nécessité de séparer les flux d’instruments sales et propres, d’organiser des espaces de nettoyage dédiés, et de coordonner les équipes sur des cycles de traitement plus longs. Cette complexité peut générer des goulots d’étranglement opérationnels, particulièrement dans les périodes de forte activité chirurgicale.
Défis de formation et de qualification du personnel
Le nettoyage efficace des instruments médicaux requiert des compétences spécialisées qui ne s’improvisent pas. La formation du personnel représente un investissement temporel et financier considérable : 40 à 80 heures de formation initiale par agent, puis 16 heures annuelles de formation continue.
La qualification et la certification du personnel selon les standards internationaux (ISO 15883, EN 17665) nécessitent des programmes de formation structurés incluant des aspects théoriques (microbiologie, chimie des détergents, réglementation) et pratiques (manipulation des équipements, techniques de nettoyage manuel, contrôle qualité).
Coûts de formation – Estimation moyenne européenne
- Formation initiale : 2 500 à 4 000 €/agent
- Formation continue : 800 à 1 200 €/agent/an
- Certification externe : 500 à 800 €/agent
- Temps de formation : 60 heures/agent/an
- Coût d’opportunité : 1 800 à 2 400 €/agent/an
Challenges spécifiques aux pays en développement
Dans les pays en développement, l’implémentation du nettoyage préalable se heurte à des obstacles structurels spécifiques. L’approvisionnement en détergents de qualité pharmaceutique peut être irrégulier ou inexistant, obligeant les établissements à développer des solutions de substitution dont l’efficacité n’est pas toujours validée.
La qualité de l’eau constitue un défi majeur : l’eau de rinçage contaminée peut recontaminer les instruments nettoyés, annulant les bénéfices du processus. Les systèmes de purification d’eau (osmose inverse, déionisation) représentent des investissements importants et nécessitent une maintenance spécialisée souvent indisponible localement.
Les interruptions d’électricité fréquentes compromettent le fonctionnement des équipements automatisés et obligent les établissements à maintenir des procédures manuelles de secours. Cette dualité des procédures complique la formation du personnel et la standardisation des pratiques.
Résistances culturelles et organisationnelles
L’implémentation du nettoyage préalable peut se heurter à des résistances culturelles, particulièrement dans les établissements où les pratiques traditionnelles sont profondément ancrées. Le passage d’une logique de stérilisation « simple » à un processus multi-étapes nécessite un changement de mentalité qui peut prendre plusieurs années à s’installer.
La perception du nettoyage comme une tâche « dégradante » peut créer des résistances parmi le personnel soignant, nécessitant un travail de valorisation et de reconnaissance de cette activité comme une composante essentielle de la sécurité des patients. Cette dimension psychosociale ne doit pas être sous-estimée dans les stratégies d’implémentation.
Chapitre 7 – Méthodes de nettoyage recommandées

Figure 6 : Technologies modernes de stérilisation et leurs interfaces avec les systèmes de nettoyage
L’évolution technologique a considérablement enrichi l’arsenal des méthodes de nettoyage disponibles pour les établissements de santé. Cette diversité permet d’adapter les procédures aux spécificités de chaque type d’instrument et aux contraintes organisationnelles de chaque établissement.
Nettoyage manuel : Techniques et optimisation
Le nettoyage manuel reste la méthode de référence pour de nombreux instruments, particulièrement ceux présentant des géométries complexes ou des matériaux sensibles. Cette technique, apparemment simple, requiert en réalité une expertise considérable et le respect de protocoles précis pour garantir son efficacité.
La phase de pré-trempage constitue l’étape cruciale du nettoyage manuel. Les instruments doivent être immergés dans une solution détergente tiède (40-45°C) dans les 30 minutes suivant leur utilisation. Cette température optimale permet l’action enzymatique sans provoquer de coagulation protéique irréversible.
La technique de brossage nécessite une attention particulière : mouvements unidirectionnels, brosses à poils souples pour éviter les rayures, démontage systématique des instruments articulés. La formation du personnel à ces gestes techniques est déterminante pour l’efficacité du processus.
Nettoyage par ultrasons : Physique et applications
La technologie ultrasonique exploite les phénomènes de cavitation pour déloger les contaminations dans les zones inaccessibles au brossage manuel. Les ondes ultrasoniques (40-80 kHz) créent des microbulles qui implosent violemment au contact des surfaces, générant des forces de cisaillement capables d’éliminer les biofilms les plus tenaces.
L’efficacité du nettoyage ultrasonique dépend de plusieurs paramètres critiques : fréquence des ultrasons, puissance émise, température du bain, composition chimique de la solution détergente, et durée d’exposition. L’optimisation de ces paramètres nécessite une approche scientifique rigoureuse et une validation expérimentale.
Les limites de cette technologie incluent l’impossibilité de traiter certains matériaux fragiles (optique, céramiques), les phénomènes d’ombrage acoustique dans les géométries complexes, et la nécessité de renouvellement fréquent des bains détergents pour maintenir l’efficacité.
Paramètres optimaux – Nettoyage ultrasonique
- Fréquence : 40 kHz (instruments standards) / 80 kHz (instruments délicats)
- Puissance : 20-40 W/litre de solution
- Température : 45-55°C selon le détergent
- Durée : 5-15 minutes selon la contamination
- Dégazage : 10 minutes avant première utilisation
- Renouvellement bain : Toutes les 4-8 heures d’utilisation
Laveurs-désinfecteurs : Automatisation et standardisation
Les laveurs-désinfecteurs représentent l’évolution technologique la plus significative dans le domaine du nettoyage des instruments médicaux. Ces équipements automatisent l’ensemble du processus de décontamination en intégrant plusieurs technologies complémentaires : lavage par aspersion, action chimique des détergents, rinçage contrôlé, et désinfection thermique.
La standardisation des cycles de lavage garantit la reproductibilité des résultats et facilite la validation réglementaire. Les cycles programmés intègrent des phases de pré-lavage (élimination des souillures grossières), lavage principal (action mécanique et chimique), rinçages intermédiaires (élimination des résidus détergents), et rinçage final (eau purifiée pour éviter les dépôts minéraux).
Les systèmes de monitoring intégrés enregistrent automatiquement tous les paramètres critiques : températures, pressions, concentrations de détergents, qualité de l’eau, durées des phases. Cette traçabilité exhaustive répond aux exigences réglementaires les plus strictes et facilite les audits qualité.
Détergents enzymatiques : Biochimie appliquée
L’utilisation de détergents enzymatiques représente une révolution dans l’efficacité du nettoyage des instruments médicaux. Ces formulations exploitent l’activité catalytique d’enzymes spécialisées pour hydrolyser spécifiquement les différents types de contamination organique.
Les protéases dégradent les protéines coagulées (sang, tissus, sécrétions), les lipases éliminent les graisses et les résidus lipidiques, les amylases hydrolysent les polysaccharides complexes, et les nucléases fragmentent l’ADN et l’ARN. Cette action multi-enzymatique assure une décontamination exhaustive même sur les souillures les plus complexes.
L’activité enzymatique dépend fortement des conditions physico-chimiques : pH optimal (généralement 7-9), température d’activation (35-50°C), concentration enzymatique, présence d’activateurs ou d’inhibiteurs. La formulation de ces détergents nécessite une expertise biochimique avancée pour garantir la stabilité et l’efficacité des enzymes.
Technologies émergentes et innovations
L’innovation technologique continue d’enrichir les possibilités de nettoyage des instruments médicaux. Les technologies plasma froid permettent une décontamination sans utilisation d’eau ni de produits chimiques, particulièrement adaptée aux instruments thermosensibles ou aux dispositifs électroniques.
Les systèmes de nettoyage par CO2 supercritique exploitent les propriétés solvantes du dioxyde de carbone sous haute pression pour éliminer les contaminations organiques sans résidus chimiques. Cette technologie, encore en développement, pourrait révolutionner le nettoyage des dispositifs les plus complexes.
L’intelligence artificielle commence à être intégrée dans les systèmes de contrôle qualité, avec des algorithmes capables d’analyser automatiquement la propreté des instruments par analyse d’images haute résolution. Ces systèmes promettent une objectivation complète du contrôle qualité et une réduction des variations inter-opérateurs.
Recommandation méthodologique : Le choix de la méthode de nettoyage doit résulter d’une analyse technique approfondie tenant compte des caractéristiques des instruments, des contraintes opérationnelles, et des exigences réglementaires. L’approche optimale combine généralement plusieurs techniques complémentaires dans un protocole intégré et validé.
Chapitre 8 – Cas particuliers et instruments complexes

Figure 7 : Systèmes spécialisés pour la stérilisation d’instruments complexes et délicats
Certaines catégories d’instruments médicaux présentent des défis particuliers qui nécessitent des adaptations spécifiques des protocoles de nettoyage. Ces cas particuliers illustrent la nécessité d’une approche individualisée et expertisée pour garantir une décontamination efficace tout en préservant l’intégrité fonctionnelle des dispositifs.
Instruments de microchirurgie : Précision et délicatesse
Les instruments de microchirurgie, utilisés en ophtalmologie, neurochirurgie, et chirurgie reconstructrice, présentent des dimensions extrêmement réduites et des tolérances de fabrication nanométriques. Ces caractéristiques imposent des protocoles de nettoyage spécialisés qui préservent leur précision tout en garantissant une décontamination complète.
Le nettoyage de ces instruments ne peut être réalisé que manuellement, avec des brosses ultra-fines et des solutions détergentes non abrasives. La moindre rayure ou déformation peut compromettre définitivement leur fonctionnalité. Les protocoles incluent un examen microscopique systématique avant et après nettoyage pour détecter d’éventuels dommages.
L’utilisation d’ultrasons est généralement proscrite en raison du risque de microfissures par fatigue métallique. Le séchage doit être réalisé par évaporation naturelle ou par flux d’air filtré à température ambiante pour éviter les contraintes thermiques. Ces précautions expliquent les coûts élevés de maintenance de ces instruments spécialisés.
Endoscopes : Défis des lumières internes
Les endoscopes représentent probablement le défi le plus complexe en matière de nettoyage préalable. Leurs canaux internes, d’un diamètre de 1 à 4 millimètres et d’une longueur pouvant atteindre 2 mètres, sont difficilement accessibles aux méthodes de nettoyage conventionnelles.
Le protocole spécialisé impose un nettoyage immédiat au point d’utilisation avec aspiration et rinçage des canaux. Cette étape, réalisée immédiatement après l’examen, prévient le séchage des sécrétions dans les lumières internes. Le transport vers l’unité de décontamination doit s’effectuer avec les canaux remplis de solution détergente.
Le nettoyage principal utilise des systèmes de circulation forcée qui propulsent les solutions détergentes à travers tous les canaux sous pression contrôlée. Ces systèmes, spécialement conçus pour les endoscopes, intègrent des adaptateurs spécifiques pour chaque modèle d’appareil et des capteurs de pression pour détecter les obstructions.
Protocole endoscopes – Étapes critiques
- Nettoyage immédiat : Aspiration + rinçage des canaux (< 10 minutes)
- Pré-nettoyage : Immersion complète, détergent enzymatique
- Nettoyage automatisé : Circulation forcée, pression contrôlée
- Test d’étanchéité : Détection fuites avant désinfection
- Rinçage final : Eau purifiée, séchage canaux air comprimé
- Contrôle microbiologique : Prélèvements canaux (hebdomadaire)
Instruments dentaires : Spécificités de la pratique odontologique
La pratique dentaire génère des contaminations particulièrement complexes combinant sang, salive, débris dentaires, et résidus de matériaux d’obturation. Ces contaminations mixtes nécessitent des approches de nettoyage spécialisées tenant compte de la diversité des souillures rencontrées.
Les instruments rotatifs (fraises, contre-angles) présentent des mécanismes internes complexes avec des roulements à billes et des systèmes de refroidissement par spray. Le nettoyage de ces dispositifs nécessite un démontage partiel et l’utilisation de détergents spécialement formulés pour éliminer les résidus de lubrifiants et les dépôts calcaires.
La diversité des matériaux utilisés en dentisterie (aciers inoxydables, alliages de titane, carbures, céramiques) impose une approche différenciée. Certains matériaux sont sensibles aux détergents alcalins, d’autres aux agents chélatants. Cette complexité nécessite une expertise spécialisée et des protocoles adaptés à chaque famille d’instruments.
Dispositifs implantables : Enjeux de biocompatibilité
Les dispositifs médicaux destinés à l’implantation temporaire ou permanente (vis orthopédiques, plaques, prothèses, stimulateurs) requièrent des niveaux de pureté exceptionnels. Tout résidu de détergent ou de contaminant peut provoquer des réactions inflammatoires graves ou des rejets d’implant.
Le nettoyage de ces dispositifs utilise exclusivement des détergents de qualité pharmaceutique, sans résidus et complètement biodégradables. Les phases de rinçage sont multipliées avec de l’eau pour injection (WFI) pour garantir l’élimination complète de tout résidu chimique.
Les contrôles qualité incluent des analyses chimiques de surface par spectroscopie pour détecter d’éventuels résidus organiques ou minéraux. Ces analyses, réalisées par échantillonnage sur chaque lot, garantissent la conformité aux standards de biocompatibilité les plus stricts (ISO 10993).
La traçabilité de ces dispositifs est exhaustive, depuis leur fabrication jusqu’à leur implantation, en passant par toutes les étapes de décontamination. Cette traçabilité permet de remonter à l’origine de toute complication et constitue une exigence réglementaire absolue pour les dispositifs implantables.
Principe directeur : La complexité des instruments modernes impose une expertise spécialisée et des protocoles individualisés. L’approche « one size fits all » n’est plus adaptée aux exigences actuelles de sécurité et d’efficacité. Chaque catégorie d’instruments nécessite une analyse spécifique et des procédures adaptées.
Conclusion
Au terme de cette analyse exhaustive, la question initiale « Faut-il nettoyer les instruments avant de les mettre dans l’autoclave ? » trouve une réponse claire et sans équivoque : OUI, le nettoyage préalable est absolument indispensable et constitue un prérequis non négociable à toute stérilisation efficace.
Cette conclusion s’appuie sur un faisceau de preuves scientifiques convergentes qui démontrent l’impossibilité d’atteindre un niveau de stérilisation satisfaisant sans élimination préalable des contaminations organiques. Les mécanismes biophysiques de protection microbienne par les biofilms et les résidus protéiques rendent illusoire toute tentative de stérilisation sur instruments non nettoyés.
Synthèse des arguments décisifs
L’analyse des protocoles internationaux révèle une unanimité remarquable : du CDC américain à l’OMS, en passant par les normes européennes et les directives APSIC, tous les organismes de référence imposent le nettoyage préalable comme étape obligatoire. Cette convergence transcende les différences culturelles, économiques et technologiques, témoignant de la solidité scientifique de cette exigence.
Les exemples concrets d’établissements hospitaliers de renommée mondiale illustrent la diversité des modalités pratiques tout en confirmant l’universalité du principe. De la Mayo Clinic avec ses détergents enzymatiques sophistiqués à l’hôpital de Dakar avec ses solutions adaptées aux ressources limitées, tous appliquent rigoureusement le nettoyage préalable.
L’analyse économique démontre que les investissements nécessaires au nettoyage préalable génèrent des retours sur investissement largement positifs. La réduction des infections nosocomiales, l’amélioration de la durée de vie des instruments, et l’optimisation des flux opérationnels compensent largement les coûts directs engagés.
Perspectives d’évolution technologique
L’avenir du nettoyage préalable s’annonce riche en innovations technologiques prometteuses. L’intelligence artificielle commence à révolutionner le contrôle qualité avec des systèmes de vision capables de détecter des contaminations invisibles à l’œil nu. Ces technologies, encore émergentes, promettent une objectivation complète du contrôle de propreté et une traçabilité numérique exhaustive.
Les nanotechnologies ouvrent des perspectives fascinantes avec le développement de surfaces auto-nettoyantes et antimicrobiennes. Les revêtements à base de nanoparticules d’argent ou de dioxyde de titane pourraient réduire significativement l’adhésion des contaminations organiques et faciliter leur élimination. Ces innovations pourraient transformer radicalement les protocoles de nettoyage dans les prochaines décennies.
La robotisation progressive des processus de nettoyage promet une standardisation accrue et une réduction de la pénibilité du travail. Les systèmes robotiques en développement pourraient assurer le démontage, le nettoyage, le rinçage et le reconditionnement des instruments avec une précision et une reproductibilité impossibles à atteindre manuellement.
Recommandations finales
Pour les établissements envisageant d’optimiser leurs protocoles de nettoyage préalable, plusieurs recommandations clés émergent de cette analyse :
Recommandations prioritaires
- Investir dans la formation : Le facteur humain reste déterminant. Une formation initiale solide et une formation continue régulière constituent le meilleur investissement pour garantir l’efficacité des protocoles.
- Privilégier l’automatisation progressive : L’acquisition d’équipements automatisés doit être planifiée selon une logique d’amélioration continue, en commençant par les instruments les plus critiques et les plus fréquemment utilisés.
- Documenter et tracer exhaustivement : La traçabilité complète des processus de nettoyage constitue à la fois une exigence réglementaire et un outil précieux d’amélioration continue.
- Adapter les protocoles au contexte local : Les solutions doivent être pragmatiques et tenir compte des contraintes économiques et logistiques spécifiques à chaque établissement.
- Mesurer et améliorer continuellement : Les indicateurs de performance (taux d’échec de stérilisation, infections nosocomiales, durée de vie des instruments) doivent être suivis régulièrement pour piloter l’amélioration des pratiques.
Message final
Le nettoyage préalable des instruments avant autoclavage n’est pas une option facultative ni une simple recommandation de bonnes pratiques. Il constitue un impératif scientifique, réglementaire et éthique qui engage la responsabilité de tous les professionnels de santé. Chaque instrument mal nettoyé représente un risque potentiel pour un patient, et cette réalité ne peut être ignorée ou minimisée.
Les progrès technologiques rendent ce processus de plus en plus accessible et efficace, y compris dans les contextes de ressources limitées. Les innovations continues dans les détergents, les équipements et les systèmes de contrôle qualité facilitent l’implémentation de protocoles performants adaptés à tous les contextes.
L’harmonisation progressive des standards internationaux témoigne de la maturation de cette discipline et de la reconnaissance universelle de son importance. Les établissements qui investissent dans des protocoles de nettoyage rigoureux ne font pas seulement un choix technique, ils affirment leur engagement envers l’excellence des soins et la sécurité de leurs patients.
En définitive, la question n’est plus « Faut-il nettoyer ? » mais plutôt « Comment optimiser le nettoyage pour garantir la meilleure sécurité possible aux patients ? » Cette évolution du paradigme reflète la maturité acquise par la communauté médicale internationale sur cette question essentielle de santé publique.
***
Article rédigé sur la base des protocoles internationaux en vigueur en 2025
CDC • OMS • APSIC • EMA • ISO 17665 • EN 15883