Blog
SURVEILLANCE DE LA STÉRILISATION À LA VAPEUR : UN GUIDE COMPLET POUR LES PROFESSIONNELS DE LA SANTÉ
INTRODUCTION
La stérilisation à la vapeur représente aujourd’hui la méthode de référence pour l’inactivation des micro-organismes sur les dispositifs médicaux réutilisables dans les établissements de santé. Cette technique, développée depuis plus d’un siècle, demeure incontournable en raison de son efficacité prouvée, de sa rapidité d’action et de son excellent rapport coût-efficacité. Cependant, l’efficacité de tout processus de stérilisation repose fondamentalement sur la qualité de sa surveillance et de son contrôle.
Dans le contexte actuel de la médecine moderne, où les interventions chirurgicales deviennent de plus en plus complexes et où les infections nosocomiales représentent un enjeu majeur de santé publique, la surveillance rigoureuse des processus de stérilisation constitue un impératif absolu. Les infections associées aux soins touchent annuellement des millions de patients dans le monde, générant non seulement une morbidité et mortalité significatives, mais également des coûts considérables pour les systèmes de santé. La prévention de ces infections passe obligatoirement par l’assurance que tous les dispositifs médicaux utilisés lors des actes invasifs sont parfaitement stérilisés.
La surveillance de la stérilisation ne peut plus être considérée comme une simple formalité administrative ou réglementaire. Elle constitue un véritable système de management de la qualité qui requiert des compétences techniques approfondies, une organisation rigoureuse et une culture de l’amélioration continue. Les professionnels de la stérilisation doivent maîtriser des concepts complexes allant de la microbiologie fondamentale aux technologies les plus avancées, en passant par la métrologie, la physique de la vapeur et la gestion des risques.
L’évolution constante des normes internationales, des réglementations nationales et des technologies impose aux professionnels de santé une mise à jour permanente de leurs connaissances et pratiques. Les normes ISO 17665, EN 285, les recommandations du CDC américain ou encore les directives européennes MDR définissent des exigences de plus en plus strictes en matière de validation, de surveillance et de traçabilité. Ces évolutions réglementaires reflètent une prise de conscience collective de l’importance critique de la stérilisation dans la chaîne de sécurité des patients.
Ce guide complet s’adresse à tous les professionnels impliqués dans les processus de stérilisation : responsables de stérilisation centrale, techniciens CSSD, responsables qualité, ingénieurs biomédicaux, mais également directions d’établissements et équipes cliniques. Il vise à fournir une approche exhaustive et pratique de la surveillance de la stérilisation à la vapeur, intégrant les dernières évolutions scientifiques, technologiques et réglementaires. L’objectif est de permettre à chaque lecteur d’optimiser ses pratiques professionnelles et de contribuer efficacement à la sécurité des patients dans son établissement.
CHAPITRE 1: PRINCIPES FONDAMENTAUX DE LA STÉRILISATION À LA VAPEUR
1.1 Mécanismes d’action de la vapeur
La stérilisation à la vapeur d’eau agit par un mécanisme de thermocoagulation des protéines microbiennes, processus irréversible qui conduit à la mort cellulaire. Contrairement à la chaleur sèche qui nécessite des températures très élevées (160°C pendant 2 heures), la chaleur humide permet d’atteindre le même niveau de stérilisation à des températures plus modérées grâce à la présence d’eau qui facilite la dénaturation protéique.
Le mécanisme d’action repose sur plusieurs phénomènes physico-chimiques simultanés. D’abord, la vapeur saturée pénètre rapidement dans les structures cellulaires grâce à sa capacité de diffusion élevée. Ensuite, la condensation de la vapeur au contact des surfaces froides libère une quantité importante d’énergie sous forme de chaleur latente (2257 kJ/kg à 100°C), créant un transfert thermique très efficace. Enfin, la présence d’eau favorise l’hydratation des protéines, les rendant plus sensibles à la dénaturation thermique.
La cinétique d’inactivation microbienne suit une loi logarithmique décroissante, caractérisée par le concept de valeur D (temps de réduction décimale). Pour Geobacillus stearothermophilus, micro-organisme de référence pour la stérilisation vapeur, la valeur D₁₂₁°C se situe entre 1,5 et 2,5 minutes, signifiant qu’à 121°C, 90% de la population microbienne est détruite en 1,5 à 2,5 minutes.
L’efficacité de la stérilisation vapeur présente des avantages considérables par rapport aux autres méthodes. Elle permet un traitement rapide (cycles de 15 à 60 minutes selon les charges), une pénétration excellente dans les matériaux poreux, une absence de résidus toxiques, et une compatibilité avec la plupart des dispositifs médicaux thermostables. De plus, la vapeur d’eau étant un agent stérilisant naturel et écologique, elle ne présente aucun risque pour l’environnement ou la santé des opérateurs.
1.2 Paramètres critiques
La stérilisation à la vapeur repose sur l’interaction synergique de quatre paramètres fondamentaux : la température, la pression, le temps et la qualité de la vapeur. Ces paramètres sont interdépendants et doivent être rigoureusement contrôlés pour garantir l’efficacité du processus.
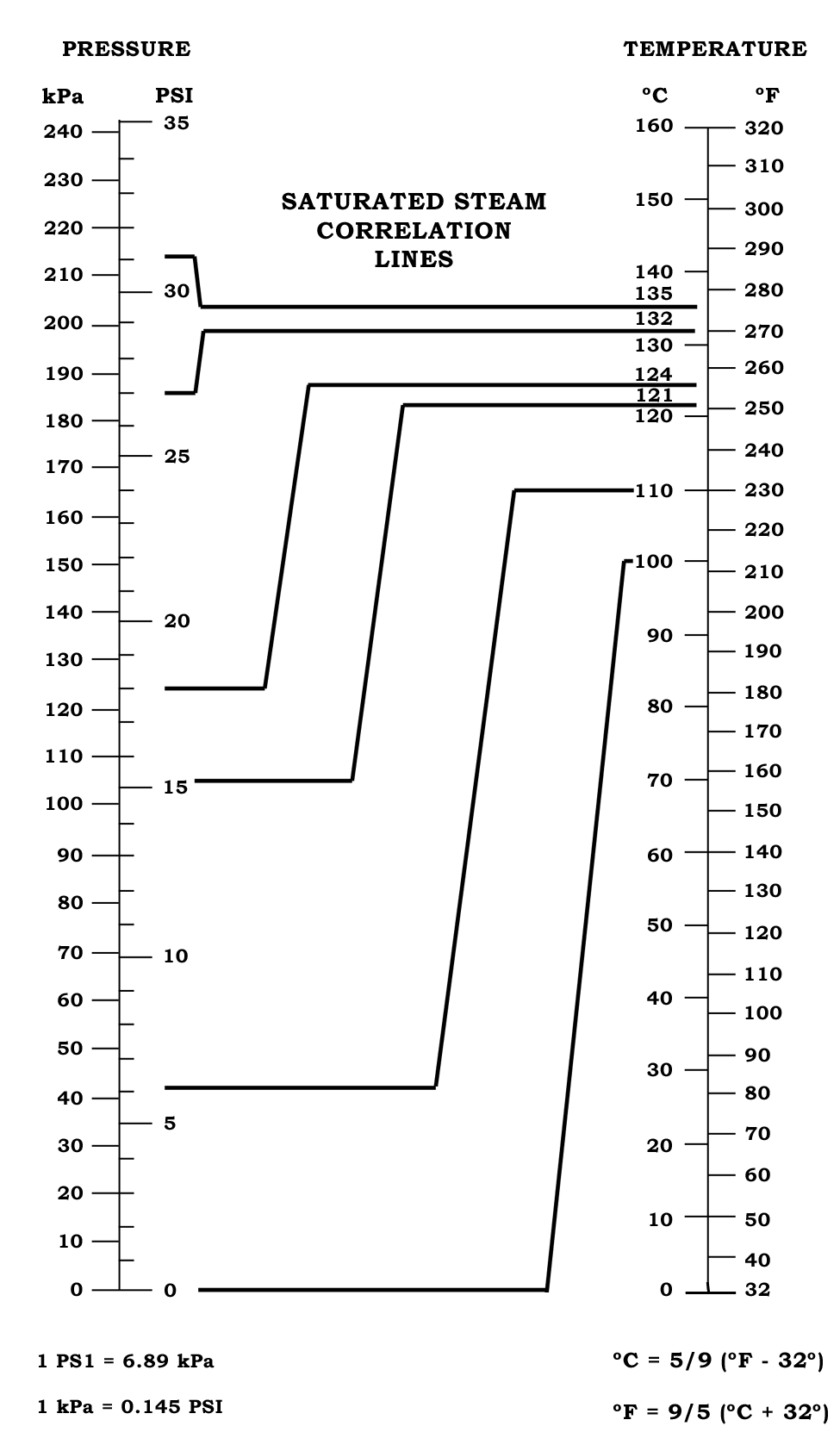
Température : Les températures de référence pour la stérilisation vapeur sont principalement 121°C (250°F) et 134°C (273°F). Le choix de la température dépend du type de charge à traiter et du niveau d’assurance stérilité souhaité. À 121°C, température historiquement établie, les cycles durent généralement 15 à 20 minutes pour les instruments et 30 à 60 minutes pour les charges poreuses. À 134°C, température plus élevée développée pour les autoclaves pré-vide, les temps d’exposition peuvent être réduits à 3-18 minutes selon les applications.
Pression : La pression dans l’autoclave est directement liée à la température par la relation de Regnault pour la vapeur saturée. À 121°C correspond une pression de 2,1 bars absolus (1,1 bar relatif), tandis qu’à 134°C la pression atteint 3,1 bars absolus (2,1 bars relatifs). Cette relation pression-température doit être strictement respectée car tout écart indique une anomalie de qualité vapeur (présence de gaz incondensables ou surchauffe).
Temps d’exposition : Le temps de stérilisation varie considérablement selon le type de charge, la température choisie et le niveau d’assurance stérilité requis (SAL : Sterility Assurance Level). Pour un SAL de 10⁻⁶ (probabilité qu’un micro-organisme viable persiste inférieure à une chance sur un million), les durées minimales sont de 15 minutes à 121°C pour les instruments métalliques et de 4 minutes à 134°C pour les mêmes charges. Les matériaux poreux nécessitent des temps plus longs en raison de la difficulté de pénétration de la vapeur.
Qualité de la vapeur : La vapeur de stérilisation doit présenter des caractéristiques physicochimiques strictement définies. Elle doit être saturée (en équilibre thermodynamique avec l’eau liquide), présenter une siccité supérieure à 0,95 (moins de 5% d’eau liquide), contenir moins de 3,5% de gaz incondensables (air résiduel, CO₂, N₂), et ne pas être surchauffée (température supérieure à celle de saturation de plus de 25°C). Ces paramètres sont définis par la norme EN 285 et contrôlés annuellement.
1.3 Types de cycles de stérilisation
Les autoclaves modernes proposent différents types de cycles adaptés aux spécificités des charges à traiter. Chaque cycle est optimisé pour un type particulier de dispositifs médicaux et présente des caractéristiques de temps, température et méthode d’évacuation de l’air spécifiques.
Cycle gravitaire : Ce cycle traditionnel utilise la différence de densité entre l’air froid et la vapeur chaude pour évacuer l’air de la chambre. L’air, plus dense, est progressivement chassé vers le bas et évacué par une purge inférieure, tandis que la vapeur, plus légère, occupe l’espace libéré. Ce processus nécessite des temps relativement longs (30 à 60 minutes de cycle total) car l’évacuation de l’air est lente et incomplète. Le cycle gravitaire convient parfaitement aux instruments métalliques pleins, aux conteneurs ouverts et aux liquides, mais présente des limitations pour les charges poreuses complexes où l’air peut être piégé.
Cycle pré-vide (classe B) : Développé pour surmonter les limitations du cycle gravitaire, le cycle pré-vide utilise une pompe à vide pour évacuer activement l’air de la chambre avant l’injection de vapeur. Le processus comprend généralement 3 à 4 pulses alternés de vide et d’injection de vapeur, permettant d’éliminer efficacement l’air même dans les zones les plus difficiles d’accès. Cette méthode garantit une pénétration optimale de la vapeur dans les matériaux poreux, les instruments creux et les emballages complexes. Les cycles pré-vide sont plus courts (15 à 45 minutes) et plus fiables, mais nécessitent un équipement plus sophistiqué et une maintenance plus rigoureuse.
Cycle flash (stérilisation immédiate) : Réservé aux situations d’urgence, ce cycle permet la stérilisation rapide d’instruments non emballés à 132-134°C pendant 3 à 10 minutes selon le type d’instrument. Bien que très efficace pour les urgences chirurgicales, la stérilisation flash présente des limitations importantes : impossibilité de stériliser des matériaux poreux, risque de recontamination lors de la manipulation post-stérilisation, et absence de protection par emballage. Son utilisation doit être strictement encadrée et limitée aux véritables urgences médicales.
Cycle liquides : Spécialement conçu pour la stérilisation des solutions aqueuses, ce cycle présente des phases de montée et descente en température très progressives pour éviter l’ébullition violente et la projection des liquides. La phase de refroidissement est particulièrement lente et contrôlée pour prévenir la formation de surpression dans les contenants fermés. Les paramètres sont ajustés selon le volume et la viscosité des liquides traités, avec des temps de cycle pouvant atteindre plusieurs heures pour de gros volumes.
CHAPITRE 2: NORMES ET RÉGLEMENTATIONS INTERNATIONALES
2.1 Normes ISO et EN
Le cadre normatif international de la stérilisation à la vapeur s’articule autour de plusieurs normes fondamentales qui définissent les exigences techniques, les méthodes d’essai et les critères de performance. Ces normes, régulièrement mises à jour, constituent la référence mondiale pour les fabricants d’équipements, les utilisateurs et les organismes de contrôle.
ISO 17665:2024 représente la norme de référence internationale pour la stérilisation des produits de santé par chaleur humide. Cette norme spécifie les exigences complètes pour le développement, la validation et le contrôle de routine des processus de stérilisation vapeur. Elle définit trois phases essentielles : la Qualification de l’Installation (QI) qui vérifie la conformité de l’équipement installé aux spécifications, la Qualification Opérationnelle (QO) qui démontre le bon fonctionnement dans les conditions d’utilisation prévues, et la Qualification de Performance (QP) qui valide l’efficacité du processus sur des charges réelles. La version 2024 intègre les dernières avancées technologiques et renforce les exigences de traçabilité.
EN 285:2015 spécifie les exigences de performance et d’essai pour les grands stérilisateurs à vapeur (volume utile supérieur à 60 litres) destinés au traitement des dispositifs médicaux. Cette norme européenne, harmonisée au niveau communautaire, définit les caractéristiques techniques obligatoires : systèmes de sécurité, instrumentation, enregistrement des paramètres, tests de performance et contrôles qualité. Elle impose notamment des tests annuels de qualité vapeur (siccité, gaz incondensables, surchauffe) et des validations périodiques complètes.
EN 13060:2014 concerne les petits stérilisateurs à vapeur (volume utile inférieur ou égal à 60 litres) et définit trois classes de performance : Classe N (cycles gravitaires simples), Classe S (cycles spécialisés définis par le fabricant), et Classe B (cycles pré-vide équivalents aux grands autoclaves). Cette classification permet aux utilisateurs de choisir l’équipement adapté à leurs besoins spécifiques et garantit des performances standardisées.
ISO 11138 série traite des indicateurs biologiques pour la validation et le contrôle de routine des processus de stérilisation. Elle spécifie les exigences pour la production, la caractérisation et l’utilisation des indicateurs biologiques, incluant les souches microbiennes de référence, les supports, les milieux de culture et les méthodes d’interprétation des résultats.
ISO 11140 série définit les indicateurs chimiques utilisés pour démontrer l’exposition des produits aux conditions de stérilisation. Elle établit une classification en six classes d’indicateurs selon leurs performances et applications, des simples indicateurs de processus (Classe 1) aux émulateurs sophistiqués (Classe 6).
2.2 Réglementations par pays
EUROPE
Le cadre réglementaire européen de la stérilisation s’appuie sur plusieurs textes législatifs et normatifs complémentaires. La Directive 93/42/CEE sur les dispositifs médicaux, bien que remplacée par le Règlement MDR 2017/745, a longtemps constitué la référence en matière d’exigences de stérilisation. Le nouveau Règlement MDR, applicable depuis mai 2021, renforce considérablement les obligations de traçabilité et de surveillance post-commercialisation.
Les normes EN harmonisées sont obligatoires pour la mise sur le marché des dispositifs médicaux stérilisés et des équipements de stérilisation. Tout établissement de santé utilisant des autoclaves doit se conformer à ces normes et faire réaliser des contrôles périodiques par des organismes accrédités COFRAC (France), DAkkS (Allemagne), ou équivalents nationaux. La fréquence minimale des contrôles externes est annuelle, mais peut être semestrielle pour les équipements critiques ou en cas d’utilisation intensive.
ÉTATS-UNIS
Aux États-Unis, la régulation de la stérilisation relève principalement de la FDA (Food and Drug Administration) pour les aspects liés aux dispositifs médicaux et au CDC (Centers for Disease Control and Prevention) pour les recommandations de santé publique.
La FDA applique le 21 CFR Part 820 (Quality System Regulation) qui impose des exigences strictes de management de la qualité pour tous les fabricants de dispositifs médicaux, incluant les processus de stérilisation. La FDA reconnaît officiellement les normes ISO, particulièrement ISO 17665-1, comme méthodes de validation acceptables. Les établissements de santé doivent démontrer la validation de leurs processus selon ces standards reconnus.
Le CDC publie les « Guidelines for Disinfection and Sterilization in Healthcare Facilities », référence nationale mise à jour régulièrement. Ces recommandations préconisent une surveillance biologique hebdomadaire minimum pour tous les stérilisateurs, avec des protocoles détaillés de gestion des tests positifs incluant la quarantaine immédiate des charges suspectes, l’investigation des causes, et le rappel éventuel des dispositifs déjà utilisés.
L’AAMI (Association for the Advancement of Medical Instrumentation) développe des standards techniques de référence, notamment ST79 « Comprehensive guide to steam sterilization and sterility assurance in healthcare facilities » et ST8 « Hospital steam sterilizers ». Ces standards, bien que volontaires, sont largement adoptés et souvent référencés dans les inspections réglementaires.
JAPON
Le système réglementaire japonais combine des exigences nationales spécifiques avec une harmonisation croissante aux standards internationaux. Le MHLW (Ministry of Health, Labour and Welfare) a publié l’Ordonnance MO#169 qui définit les exigences de système qualité pour les dispositifs médicaux, largement harmonisée avec ISO 13485 mais incluant des spécificités japonaises.
La PMDA (Pharmaceuticals and Medical Devices Agency), agence d’évaluation des médicaments et dispositifs médicaux, conduit des inspections régulières des établissements de santé et impose la validation des processus de stérilisation selon ISO 17665. Les standards JIS (Japanese Industrial Standards) complètent le dispositif réglementaire avec des exigences techniques détaillées.
Tableau Comparatif International :
| Aspect | Europe | USA | Japon |
|---|---|---|---|
| Fréquence BI | Hebdomadaire | Hebdomadaire (CDC) | Hebdomadaire |
| Validation | ISO 17665 | FDA 21 CFR 820 | MHLW MO#169 |
| Contrôle qualité vapeur | EN 285 (annuel) | AAMI ST79 | JIS standards |
| Traçabilité | Obligatoire MDR | Obligatoire 21 CFR | Obligatoire PMD Act |
CHAPITRE 3: INDICATEURS DE SURVEILLANCE
3.1 Indicateurs Biologiques (IB)
Les indicateurs biologiques constituent l’étalon-or de la surveillance de stérilisation car ils utilisent des micro-organismes vivants pour évaluer directement l’efficacité létale du processus. Contrairement aux autres méthodes de surveillance qui mesurent des paramètres physiques ou chimiques, les IB fournissent une mesure biologique directe de la capacité stérilisante.
Principe et microorganisme : Le micro-organisme de référence pour la stérilisation vapeur est Geobacillus stearothermophilus (anciennement Bacillus stearothermophilus), bactérie thermophile sporulée présentant une résistance thermique élevée. Les spores de cette bactérie sont naturellement plus résistantes à la chaleur humide que la plupart des micro-organismes pathogènes, offrant ainsi une marge de sécurité appropriée. La population standard des IB se situe entre 10⁵ et 10⁶ spores par indicateur, avec une valeur D₁₂₁°C comprise entre 1,5 et 2,5 minutes et une valeur Z d’environ 10°C (variation de 7 à 12°C selon les souches).
Types d’indicateurs biologiques : Trois principales catégories d’IB sont disponibles sur le marché. Les ampoules auto-contenues intègrent les spores et le milieu de culture dans un système unique, permettant une incubation directe après exposition sans manipulation supplémentaire, avec lecture des résultats après 24 à 48 heures d’incubation à 56-60°C. Les strips papier portent les spores sur un support papier ou textile et nécessitent un transfert aseptique vers un milieu de culture séparé après exposition. Les systèmes de lecture rapide utilisent des substrats enzymatiques fluorogènes pour détecter l’activité métabolique des spores survivantes, permettant d’obtenir des résultats en 1 à 3 heures seulement.
Fréquence d’utilisation : Les recommandations internationales convergent vers une surveillance biologique hebdomadaire minimum pour tous les stérilisateurs. Cependant, une fréquence quotidienne est fortement recommandée pour les autoclaves utilisés intensivement (plus de 3-4 cycles par jour). Certaines situations imposent une surveillance systématique : chaque charge contenant des implants ou dispositifs invasifs critiques, après toute intervention de maintenance ou réparation, lors de la validation de nouveaux cycles ou charges, et en cas de suspicion de dysfonctionnement.
Placement dans l’autoclave : Le positionnement des IB est crucial pour la validité du test. Ils doivent être placés dans la zone la plus difficile à stériliser de la charge, généralement au centre géométrique pour les charges poreuses ou dans les points froids identifiés lors de la validation thermique. L’utilisation de PCD (Process Challenge Device) standardisés, tels que ceux définis par les normes ISO 11140-4 et EN 867-5, garantit la reproductibilité et la représentativité des tests.
Interprétation des résultats : Un résultat négatif (absence de virage colorimétrique ou de trouble) indique que toutes les spores ont été tuées et valide l’efficacité de la stérilisation. Un résultat positif (virage de couleur ou apparition de trouble) signale la survie de micro-organismes et nécessite une investigation immédiate selon le protocole établi par le CDC : arrêt immédiat de l’utilisation de l’autoclave, mise en quarantaine de la charge suspecte, rappel des instruments si déjà utilisés, investigation des causes possibles, re-test sur trois cycles consécutifs avec IB, et maintenance corrective si l’échec persiste.
3.2 Indicateurs Chimiques (IC)
Les indicateurs chimiques complètent la surveillance biologique en fournissant une réponse immédiate aux conditions de stérilisation. Ils utilisent des substances chimiques qui changent de couleur, de forme ou d’état physique en réponse à l’exposition aux paramètres de stérilisation (température, temps, vapeur).
Classification ISO 11140-1 : La norme internationale définit six classes d’indicateurs chimiques, chacune adaptée à des applications spécifiques et présentant des niveaux de performance croissants.
Classe 1 – Indicateurs de processus : Ces indicateurs les plus simples utilisent des encres thermosensibles qui changent de couleur lorsque exposées à une température élevée. Ils se présentent généralement sous forme de rubans adhésifs ou d’étiquettes et ne réagissent qu’à un seul paramètre (température). Leur fonction exclusive est de distinguer visuellement les articles traités des non traités. Ils doivent être apposés sur chaque emballage extérieur mais ne fournissent aucune information sur l’efficacité réelle du cycle de stérilisation.
Classe 2 – Indicateurs spécifiques : Cette classe comprend les tests de performance spécialisés conçus pour évaluer des aspects particuliers du processus de stérilisation. Les plus importants sont le test Bowie-Dick et le test Helix. Le test Bowie-Dick évalue l’efficacité de l’évacuation de l’air et la pénétration de la vapeur dans les autoclaves pré-vide. Il utilise un pack standardisé contenant des feuilles de papier avec un indicateur chimique central, exposé pendant 3,5 minutes à 134°C. Un virage uniforme indique une pénétration correcte de la vapeur. Le test Helix valide la stérilisation des instruments creux à l’aide d’un tube de 1,5 mètre de long et 2 mm de diamètre interne, conforme à la norme EN 867-5.
Classe 3 – Indicateur monoparamétrique : Ces indicateurs réagissent à un seul paramètre critique, généralement la température. Ils présentent des limitations importantes car ils ne tiennent pas compte de l’interaction entre les différents paramètres de stérilisation et ne sont pas recommandés pour une utilisation isolée.
Classe 4 – Indicateur multiparamétrique : Ces indicateurs réagissent à au moins deux paramètres parmi la température, le temps et la présence de vapeur. Ils doivent être utilisés dans chaque paquet pour vérifier que les conditions de stérilisation ont été atteintes à l’intérieur de l’emballage. Ils offrent une validation partielle du cycle mais ne simulent pas la résistance microbienne.
Classe 5 – Intégrateurs : Les intégrateurs représentent la classe la plus sophistiquée d’indicateurs chimiques. Ils sont conçus pour simuler la résistance de micro-organismes spécifiques en intégrant la réponse aux trois paramètres critiques (température, temps, vapeur). Leur performance est calibrée pour correspondre à la valeur D d’un micro-organisme de référence, offrant ainsi une corrélation avec les indicateurs biologiques. Ils doivent être placés au centre des paquets et dans les endroits les plus difficiles à stériliser.
Classe 6 – Émulateurs : Ces indicateurs sont conçus pour des cycles spécifiques et réagissent uniquement aux paramètres exacts de ces cycles prédéfinis. Ils sont plus restrictifs que les intégrateurs de Classe 5 et offrent une spécificité maximale pour des applications particulières.
Protocole d’utilisation : L’utilisation correcte des indicateurs chimiques nécessite le respect de protocoles stricts. Tous les emballages doivent porter un indicateur de Classe 1 en externe pour identification visuelle. Chaque paquet doit contenir un indicateur de Classe 4, 5 ou 6 en interne pour vérifier les conditions de stérilisation. Les tests Bowie-Dick doivent être réalisés quotidiennement sur tous les autoclaves pré-vide. Tous les résultats doivent être documentés et archivés selon les exigences réglementaires.
3.3 Surveillance mécanique
La surveillance mécanique constitue le troisième pilier du système de monitoring de la stérilisation. Elle fournit un enregistrement continu et objectif des paramètres physiques du cycle, permettant une analyse détaillée des performances et la détection précoce d’anomalies.
Enregistrements électroniques : Les autoclaves modernes sont équipés d’enregistreurs graphiques ou numériques qui monitoring en temps réel les paramètres critiques. La température de chambre est mesurée par des sondes multiples (généralement 3 à 15 selon la taille de l’autoclave) positionnées en différents points pour détecter d’éventuelles hétérogénéités. La pression de chambre est enregistrée en continu pour vérifier la relation température-pression caractéristique de la vapeur saturée. Le temps de plateau est mesuré précisément depuis l’atteinte de la température de consigne jusqu’à l’ouverture de la purge finale. Pour les autoclaves pré-vide, la qualité du vide est surveillée lors des phases d’évacuation de l’air.
Alarmes et sécurités : Les systèmes de surveillance intègrent des alarmes automatiques qui se déclenchent en cas d’écart aux paramètres programmés : déviations de température ou pression par rapport aux consignes, durée de plateau insuffisante, détection de fuites d’air ou de vapeur, ou échec général de stérilisation. Ces alarmes permettent une intervention immédiate et préviennent la libération de charges non conformes.
Traçabilité : Chaque cycle reçoit un numéro unique permettant une traçabilité complète. Les enregistrements incluent la date et heure précises, l’identification de l’opérateur, le type de charge traité, les paramètres mesurés, et les résultats des indicateurs. Cette documentation doit être conservée selon les exigences réglementaires (généralement 5 à 10 ans) et être accessible pour les audits et investigations.
CHAPITRE 4: QUALITÉ DE LA VAPEUR
4.1 Caractéristiques de la vapeur de stérilisation
La qualité de la vapeur constitue un facteur déterminant de l’efficacité de la stérilisation. Une vapeur de mauvaise qualité peut compromettre totalement le processus, même si les autres paramètres (température, temps, pression) semblent corrects. La norme EN 285 définit précisément les caractéristiques que doit présenter la vapeur de stérilisation.
Vapeur saturée : L’état idéal pour la stérilisation est la vapeur saturée, c’est-à-dire en équilibre thermodynamique avec l’eau liquide. Dans cet état, la vapeur présente une relation constante et prévisible entre pression et température, permettant un transfert de chaleur optimal par condensation. Lorsque la vapeur saturée entre en contact avec une surface plus froide, elle condense instantanément en libérant une quantité considérable d’énergie sous forme de chaleur latente (2257 kJ/kg à 100°C). Cette libération d’énergie assure un chauffage rapide et uniforme des surfaces à stériliser.
Fraction de siccité (dryness) : La siccité de la vapeur exprime la proportion de vapeur pure par rapport à la masse totale du mélange vapeur-eau. Elle est définie comme le rapport entre la masse de vapeur et la masse totale (vapeur + gouttelettes d’eau en suspension). La norme EN 285 exige une siccité minimale de 0,95, signifiant que la vapeur ne doit pas contenir plus de 5% d’eau liquide. Une siccité insuffisante entraîne plusieurs problèmes : refroidissement des surfaces par évaporation de l’eau liquide, dilution de l’effet stérilisant, humidification excessive des emballages pouvant compromettre leur intégrité, et risque de recontamination lors du séchage.
Gaz incondensables (NCG) : Les gaz incondensables comprennent tous les gaz qui ne se liquéfient pas aux conditions de stérilisation : air résiduel (N₂, O₂), dioxyde de carbone (CO₂), et autres gaz dissous dans l’eau d’alimentation. Ces gaz constituent une isolation thermique entre la vapeur et les surfaces à stériliser, réduisant drastiquement l’efficacité du transfert de chaleur. La norme EN 285 limite leur concentration à 3,5% du volume total. La présence excessive de gaz incondensables se manifeste par la formation de poches d’air froid, une stérilisation incomplète et l’impossibilité d’atteindre le niveau d’assurance stérilité (SAL) requis.
Surchauffe : La surchauffe caractérise une vapeur dont la température est supérieure à celle de saturation à la pression considérée. Une vapeur surchauffée de plus de 25°C au-dessus de la température de saturation présente des propriétés de transfert thermique dégradées, similaires à celles de l’air chaud. Elle peut également provoquer la déshydratation et la carbonisation des emballages, compromettant leur fonction de barrière microbienne et leur intégrité mécanique.
4.2 Tests qualité vapeur (EN 285)
La norme EN 285 impose des tests périodiques de qualité vapeur pour tous les stérilisateurs de plus de 60 litres. Ces tests, obligatoires au minimum annuellement, doivent être réalisés par des organismes accrédités et selon des protocoles standardisés.
Tests obligatoires annuels : Trois tests principaux évaluent la qualité de la vapeur. Le test de siccité mesure la fraction de vapeur pure et doit démontrer une valeur ≥ 0,95. Le test de gaz incondensables quantifie la concentration des gaz non condensables et doit établir une valeur ≤ 3,5%. Le test de surchauffe vérifie que la température de la vapeur n’excède pas de plus de 25°C la température de saturation à la pression mesurée.
Protocole d’exécution : Les tests sont réalisés dans des conditions standardisées sur un autoclave vide. La vapeur est injectée selon un protocole défini (pression, température, durée) et des prélèvements sont effectués à des points spécifiques pour analyses. Les mesures doivent être effectuées avec des instruments étalonnés et traçables aux standards nationaux. Un rapport d’analyse détaillé est établi par l’organisme accrédité, incluant les résultats, les incertitudes de mesure et la conformité aux exigences normatives.
4.3 Traitement de l’eau d’alimentation
La qualité de l’eau d’alimentation des générateurs de vapeur influence directement les caractéristiques de la vapeur produite et la durée de vie des équipements. Les impuretés présentes dans l’eau peuvent se concentrer lors de la vaporisation et affecter les propriétés stérilisantes de la vapeur.
Exigences qualité eau : La norme EN 285 spécifie une conductivité maximale de 15 μS/cm à 25°C, indicateur de la pureté ionique globale. L’eau doit être exempte de métaux lourds, de chlorures en excès, de silice colloïdale et de matières organiques. Le pH doit être maintenu entre 5 et 7 pour prévenir la corrosion des circuits vapeur. Ces exigences visent à éviter la formation de dépôts dans les générateurs, la corrosion des composants métalliques, et le développement de biofilms.
Systèmes de traitement : Plusieurs technologies peuvent être utilisées pour produire l’eau de qualité requise. L’osmose inverse élimine la majorité des impuretés ioniques et organiques par filtration membranaire. Les échangeurs d’ions remplacent les cations et anions indésirables par des ions H⁺ et OH⁻. La distillation produit une eau de très haute pureté par vaporisation-condensation. Quel que soit le système choisi, des contrôles réguliers de qualité eau doivent être réalisés selon la fréquence définie par l’analyse de risque (généralement quotidiens à hebdomadaires).
CHAPITRE 5: VALIDATION DES CYCLES DE STÉRILISATION
5.1 Qualification de l’Installation (QI)
La Qualification de l’Installation constitue la première étape de la validation d’un autoclave. Elle vérifie que l’équipement installé correspond aux spécifications prévues et que tous les éléments nécessaires au bon fonctionnement sont présents et correctement raccordés.
Documentation technique : La QI débute par la vérification de la documentation complète : plans d’installation et schémas de principe, spécifications techniques du fabricant incluant les performances garanties, manuels d’utilisation et de maintenance traduits dans la langue locale, certificats de conformité aux normes applicables (CE, FDA, etc.), et documentation des raccordements aux utilités (vapeur, eau, électricité, air comprimé, évacuations). Cette documentation doit être conservée pendant toute la durée de vie de l’équipement et mise à jour lors des modifications.
Vérifications : Les contrôles portent sur plusieurs aspects critiques. La conformité aux normes applicables (ISO 17665, EN 285 ou EN 13060 selon le type d’autoclave) doit être documentée par les certificats appropriés. Tous les dispositifs de sécurité et systèmes d’alarme doivent être présents et fonctionnels : soupapes de sécurité, détecteurs de pression, thermostats de sécurité, alarmes sonores et visuelles. L’instrumentation doit être complète et étalonnée : sondes de température et pression, enregistreurs, systèmes de contrôle-commande. Enfin, la formation initiale des utilisateurs doit être documentée et adaptée aux spécificités de l’équipement.
5.2 Qualification Opérationnelle (QO)
La Qualification Opérationnelle démontre que l’autoclave fonctionne correctement dans ses conditions d’utilisation prévues, sans charge. Elle comprend une série de tests standardisés qui évaluent les performances de base de l’équipement.
Tests physiques : Le test d’étanchéité (leak test) évalue l’intégrité de la chambre et des circuits. Un vide de -0,90 bar est établi dans la chambre vide et fermée. L’augmentation de pression ne doit pas excéder 1,3 kPa en 10 minutes. Ce test, obligatoire quotidiennement pour les autoclaves pré-vide, permet de détecter les fuites d’air qui compromettraient l’efficacité de l’évacuation de l’air et de la pénétration de vapeur.
Le test Bowie-Dick, spécifique aux autoclaves pré-vide, utilise un pack standardisé conforme à ISO 11140-4 ou EN 867-5. Ce pack, composé de feuilles de textile ou papier avec un indicateur chimique central, est exposé pendant exactement 3,5 minutes à 134°C. Un virage uniforme de l’indicateur sur toute sa surface témoigne d’une élimination correcte de l’air et d’une pénétration homogène de la vapeur. Ce test doit être réalisé quotidiennement avant la première charge.
Les mesures de température constituent un élément crucial de la QO. Des sondes multiples (généralement 9 à 15 selon la taille de l’autoclave) sont positionnées en différents points de la chambre pour établir une cartographie thermique précise. Cette cartographie permet d’identifier d’éventuelles zones froides où la température pourrait être insuffisante. L’homogénéité thermique requise est généralement de ±2°C par rapport à la température de consigne.
Les tests de pénétration vapeur évaluent la capacité de la vapeur à atteindre tous les points de charges standardisées représentatives. Des charges poreuses normalisées (textiles, papiers) sont instrumentées avec des indicateurs au centre géométrique et aux points les plus difficiles d’accès. Ces tests valident les temps nécessaires à la pénétration complète de la vapeur et déterminent les durées minimales de stérilisation.
5.3 Qualification de Performance (QP)
La Qualification de Performance valide l’efficacité du processus de stérilisation sur des charges réelles représentatives de l’utilisation quotidienne. Elle constitue l’étape finale et la plus critique de la validation.
Validation charges réelles : La QP doit couvrir toutes les configurations de charges prévues en utilisation routine : charges maximales et minimales, différents types d’instruments (métalliques, plastiques, textiles), diverses configurations d’emballage (sachets, conteneurs, wraps), et positions de chargement selon les procédures opératoires normalisées (SOP). Chaque type de charge représentative doit faire l’objet d’une validation spécifique.
Protocole de validation : Pour chaque configuration de charge, un minimum de trois cycles consécutifs doit être réalisé dans des conditions identiques. Chaque cycle est instrumenté avec de multiples indicateurs biologiques (généralement 9 à 12 par charge) positionnés dans les zones les plus difficiles à stériliser identifiées lors de la cartographie thermique. Des indicateurs chimiques de Classe 5 ou 6 complètent le dispositif de surveillance. Des sondes de température peuvent être placées à l’intérieur des charges pour vérifier les cinétiques de montée en température. Le critère de succès absolu exige que 100% des indicateurs biologiques soient négatifs et que tous les indicateurs chimiques présentent un virage conforme aux spécifications.
Fréquence de revalidation : La revalidation périodique est obligatoire selon une fréquence minimale annuelle. Elle doit également être réalisée après toute modification significative des cycles ou des charges, après maintenance majeure affectant les performances, ou en cas d’échec répété des contrôles de routine. La revalidation peut être allégée (QO + QP partielle) ou complète (QI + QO + QP) selon l’ampleur des modifications.
5.4 Documentation et traçabilité
La documentation constitue un élément essentiel de la validation et du contrôle de routine. Elle doit permettre la traçabilité complète de chaque cycle et la démonstration de la conformité aux exigences réglementaires.
Dossier de lot (batch record) : Chaque cycle de stérilisation génère un dossier complet comprenant un numéro de cycle unique et horodaté, l’identification de l’opérateur et du responsable de libération, la description détaillée du type de charge et de son contenu, les paramètres programmés et mesurés du cycle (température, pression, durée de chaque phase), les résultats complets des indicateurs chimiques et biologiques, les graphiques d’enregistrement des paramètres, et la décision de libération ou rejet avec signature du responsable habilité.
Logiciels de gestion : Les systèmes informatisés modernes permettent une traçabilité bidirectionnelle complète. La traçabilité ascendante permet de remonter depuis un patient vers tous les instruments utilisés lors de son intervention. La traçabilité descendante permet d’identifier tous les patients ayant été exposés aux instruments d’un cycle donné en cas de problème détecté a posteriori. Ces systèmes intègrent des alertes automatiques en cas d’écart aux paramètres, un archivage électronique sécurisé avec sauvegarde, et une conservation des données conforme aux exigences réglementaires (généralement 5 à 20 ans selon les pays et types d’établissements).
CHAPITRE 6: WORKFLOW DU CSSD (Central Sterile Services Department)
6.1 Organisation spatiale du CSSD
L’organisation architecturale du CSSD constitue un élément fondamental de la maîtrise de la contamination et de l’efficacité du processus de stérilisation. La conception doit impérativement respecter le principe du flux unidirectionnel pour prévenir les contaminations croisées.
Séparation physique obligatoire : Le CSSD comprend trois zones distinctes avec séparation physique complète. La zone sale (décontamination) reçoit les instruments souillés pour réception, tri, nettoyage et décontamination. Elle doit être maintenue en dépression relative pour éviter la dissémination des contaminants. La zone propre abrite les activités d’inspection, d’assemblage, d’emballage et de préparation des charges. Elle constitue une zone de transition maintenue à pression neutre. La zone stérile comprend les autoclaves, les aires de refroidissement et de stockage des produits stérilisés. Elle doit être maintenue en surpression positive pour prévenir toute recontamination. Le flux unidirectionnel impose un déplacement obligatoire Sale → Propre → Stérile sans possibilité de retour en arrière.
Infrastructure CDC : Les recommandations du CDC imposent des séparations physiques complètes par des murs pleins hauteur, sans communication aérienne directe entre les zones. Les pressions différentielles doivent être maintenues et contrôlées : zone sale en dépression (-2,5 Pa), zone propre à pression neutre (référence), zone stérile en surpression (+2,5 Pa minimum). La ventilation HVAC doit être conçue spécifiquement avec des taux de renouvellement d’air appropriés (10-15 vol/h minimum) et une filtration adaptée (HEPA en zone stérile). Les accès entre zones sont contrôlés par des sas avec portes à verrouillage mutuel.
6.2 Étapes du processus
1. Réception et décontamination (Zone sale) : Les instruments usagés sont collectés dans des chariots dédiés étanches et acheminés directement vers la zone sale. Le tri s’effectue selon la nature des instruments (métalliques, plastiques, optiques), le niveau de contamination (sang, matières organiques, prions), et les exigences de traitement (nettoyage manuel, automatique, ultrasons). Le nettoyage constitue l’étape la plus critique car aucune stérilisation n’est efficace sur des instruments sales. Il peut être manuel (brossage, détergents enzymatiques) ou automatique par laveurs-désinfecteurs conformes à EN ISO 15883. Les ultrasons sont utilisés pour les instruments complexes (optiques, micro-chirurgie) et les cavités difficilement accessibles. Les enzymes multiples (protéases, lipases, amylases) facilitent la dégradation des souillures protéiques. Le rinçage final à l’eau déminéralisée élimine les résidus de détergents et de minéraux. Le séchage complet est obligatoire avant passage en zone propre pour éviter la prolifération microbienne et la corrosion.
2. Inspection et assemblage (Zone propre) : Chaque instrument fait l’objet d’un contrôle visuel minutieux sous éclairage intensif et avec loupes si nécessaire. Cette inspection vérifie la propreté résiduelle (absence de souillures, dépôts), l’intégrité fonctionnelle (articulations, tranchants, mécanismes), et l’absence de défauts (corrosion, fissures, usure excessive). Les instruments défaillants sont écartés pour réparation ou réforme. L’assemblage des plateaux et sets chirurgicaux s’effectue selon des protocoles standardisés avec nomenclatures précises. La lubrification des instruments articulés utilise des produits compatibles avec la stérilisation vapeur.
3. Emballage (Zone propre) : Le choix de l’emballage dépend du type d’instrument, de la fréquence d’utilisation et de la durée de stockage prévue. Les sachets papier-plastique autoscellants conviennent aux instruments individuels ou petits sets, avec indicateurs intégrés et transparence permettant l’identification du contenu. Les feuilles SMS (Spunbond-Meltblown-Spunbond) offrent une excellente barrière microbienne pour les gros instruments et plateaux. Les conteneurs rigides réutilisables, plus coûteux à l’achat, sont économiques pour les sets volumineux à rotation rapide. Les enveloppes textiles de Classe IIa combinent réutilisabilité et performances de barrière.
Exigences emballage : Tout emballage de stérilisation doit présenter des caractéristiques spécifiques : perméabilité à la vapeur pour permettre la pénétration du stérilisant, imperméabilité aux micro-organismes pour maintenir la stérilité, résistance mécanique aux déchirures et perforations, et compatibilité avec les conditions de stérilisation (température, humidité). L’étiquetage obligatoire comprend la description du contenu, la date de stérilisation, le numéro de cycle, l’identification de l’opérateur, et la date de péremption si applicable. Un indicateur chimique de Classe 1 doit être visible sur l’emballage externe, et un indicateur de Classe 4-5 placé à l’intérieur du paquet.
4. Stérilisation (Zone stérile) : Le chargement de l’autoclave respecte des règles précises pour optimiser la circulation de vapeur. La surcharge doit être évitée car elle entrave la pénétration vapeur et le séchage. Les instruments métalliques sont placés à plat pour faciliter l’évacuation de l’air et l’écoulement des condensats. Les charges poreuses sont positionnées verticalement pour favoriser la circulation vapeur. Le cycle choisi doit être adapté au type de charge selon les validations réalisées. Les indicateurs biologiques sont placés selon le protocole établi lors de la validation.
5. Refroidissement et déchargement : Le refroidissement complet des charges est impératif avant toute manipulation pour éviter la condensation qui humidifierait les emballages et compromettrait leur intégrité. L’inspection visuelle post-stérilisation vérifie l’intégrité des emballages (absence de déchirures, perforations, humidité) et le virage correct des indicateurs chimiques externes. Tout emballage présentant une anomalie doit être rejeté et son contenu retraité.
6. Stockage stérile : La zone de stockage stérile doit respecter des conditions environnementales contrôlées : température entre 18 et 22°C, hygrométrie relative entre 35 et 70%, accès limité au personnel autorisé. Les étagères doivent être aérées et maintenir des distances minimales (15-20 cm des murs, sol et plafond) pour la circulation d’air. La rotation des stocks suit le principe FIFO (First In First Out) pour minimiser les durées de stockage. La protection contre la poussière et la lumière directe préserve l’intégrité des emballages.
7. Distribution et traçabilité : La distribution utilise des chariots propres dédiés, différents de ceux utilisés pour la collecte des instruments souillés. L’enregistrement de chaque sortie comprend le numéro de lot, la destination (service, bloc opératoire), et l’identification du réceptionnaire. Les liaisons informatiques entre le CSSD et les services utilisateurs permettent un suivi temps réel et la possibilité de rappel en cas de problème détecté a posteriori.
6.3 Gestion péremption
Concept event-related sterility : La stérilité moderne est basée sur le concept d' »event-related sterility » plutôt que sur une date de péremption fixe. Selon ce principe, la stérilité est maintenue tant que l’emballage demeure intact, indépendamment du temps écoulé. La péremption survient lors d’un événement compromettant l’intégrité de l’emballage : manipulation brusque, chute, contact avec des surfaces contaminées, ou détérioration visible de l’emballage. Ce concept nécessite un contrôle de l’intégrité à chaque manipulation et une formation du personnel aux bonnes pratiques de manipulation.
Durées indicatives selon emballage : Bien que le concept event-related soit privilégié, des durées indicatives sont souvent établies pour la gestion pratique : sachets simple épaisseur 6 mois, double emballage (sachet dans sachet ou wrap) 12 mois, conteneurs rigides avec joints d’étanchéité 6 à 12 mois selon le fabricant, enveloppes SMS 6 mois en moyenne. Ces durées peuvent être étendues si l’analyse de risque le justifie et que des études de vieillissement le démontrent.
CHAPITRE 7: MAINTENANCE ET CONTRÔLES PÉRIODIQUES
7.1 Maintenance préventive
La maintenance préventive des autoclaves constitue un élément déterminant de la fiabilité et de la sécurité du processus de stérilisation. Un programme de maintenance structuré et rigoureusement appliqué permet de prévenir les pannes, d’optimiser les performances et de prolonger la durée de vie des équipements.
Fréquence quotidienne : Les opérations quotidiennes incluent le nettoyage complet de la chambre et de la porte avec des produits non corrosifs, la vidange complète du réservoir d’eau avec remplissage d’eau fraîche de qualité appropriée, le test d’étanchéité obligatoire pour les autoclaves pré-vide (leak test à -0,90 bar, augmentation ≤ 1,3 kPa en 10 min), et le test Bowie-Dick pour les autoclaves pré-vide avant la première charge. L’inspection visuelle des joints de porte détecte les signes d’usure, fissures ou déformations. Le nettoyage du filtre à air assure une qualité d’air optimale.
Fréquence hebdomadaire : Les tâches hebdomadaires comprennent le nettoyage approfondi de tous les filtres (air, vapeur, condensats), la vérification minutieuse de l’état des joints de porte avec test de fermeture et pression, et le test avec indicateur biologique obligatoire pour valider l’efficacité de stérilisation. Le contrôle visuel des tuyauteries détecte fuites, corrosion ou dépôts. La vérification du système de drainage prévient les obstructions.
Fréquence mensuelle : Mensuellement, il convient de contrôler le fonctionnement de toutes les sécurités et alarmes (soupapes, thermostats, détecteurs), vérifier l’intégrité et le fonctionnement des vannes et tuyauteries, tester l’intégrité des systèmes de contrôle-commande et enregistrement, contrôler les niveaux et qualité des fluides (huile de pompe à vide si applicable), et nettoyer les capteurs de température et pression.
Fréquence trimestrielle : La maintenance préventive trimestrielle, réalisée par un technicien qualifié, inclut le remplacement préventif des pièces d’usure (joints, filtres, clapets), l’étalonnage des sondes et capteurs critiques, la vérification et ajustement de la programmation des cycles, le contrôle des systèmes électriques et électroniques, la lubrification des mécanismes mobiles (charnières, verrous de porte), et l’inspection des éléments chauffants et générateurs de vapeur.
Fréquence annuelle : La maintenance annuelle constitue une intervention majeure comprenant la requalification complète (QI/QO/QP selon ISO 17665), les tests obligatoires de qualité vapeur selon EN 285 (siccité, gaz incondensables, surchaufte), le réétalonnage métrologique complet avec traçabilité aux standards nationaux par organisme accrédité COFRAC/ISO 17025, la mise à jour logicielle et firmware, le remplacement systématique des consommables critiques, et l’établissement d’un rapport complet de conformité.
7.2 Étalonnage des instruments de mesure
La fiabilité de la surveillance repose sur la précision des instruments de mesure. Un programme d’étalonnage rigoureux garantit la validité des mesures et la conformité réglementaire.
Sondes température : Les sondes de température constituent les instruments les plus critiques de la surveillance. Elles doivent faire l’objet d’un étalonnage accrédité COFRAC ou équivalent ISO 17025 assurant la traçabilité aux standards nationaux (NIST aux USA, PTB en Allemagne, LNE en France). Le certificat d’étalonnage doit indiquer les valeurs mesurées, les écarts constatés, l’incertitude de mesure, et la conformité aux spécifications. L’intervalle d’étalonnage est généralement de 6 à 12 mois selon l’utilisation et les exigences réglementaires. Le critère d’acceptation pour la stérilisation est typiquement de ±0,5°C, certaines applications critiques exigeant ±0,3°C.
Capteurs pression : Les capteurs et manomètres de pression nécessitent un étalonnage par rapport à des manomètres étalons traçables. Les vérifications incluent le zéro (pression atmosphérique) et plusieurs points de l’étendue de mesure. Le certificat de traçabilité doit être conservé avec le dossier de l’équipement. L’intervalle d’étalonnage standard est de 12 mois, avec vérification intermédiaire possible tous les 6 mois pour les équipements critiques.
7.3 Gestion des écarts et non-conformités
La gestion rigoureuse des écarts et non-conformités constitue un élément essentiel du système qualité. Elle assure la sécurité des patients et l’amélioration continue des processus.
Procédure en cas d’échec indicateur biologique : La détection d’un indicateur biologique positif déclenche un protocole d’urgence strictement codifié. L’arrêt immédiat de l’utilisation de l’autoclave est impératif, avec signalisation visible (pancarte, verrouillage électronique). La mise en quarantaine de la charge suspecte s’effectue dans une zone dédiée avec étiquetage clair « Quarantaine – Ne pas utiliser ».
L’investigation débute par la vérification exhaustive des enregistrements du cycle (graphes température/pression, durées de phases, alarmes), le contrôle de tous les indicateurs chimiques de la charge, la vérification du positionnement correct de l’IB dans la charge, et la recherche de causes techniques (qualité vapeur, dysfonction équipement, erreur de programmation, surcharge).
Le re-test consiste en l’exécution de trois cycles consécutifs avec indicateurs biologiques dans des conditions identiques. Si ces trois tests sont négatifs, l’autoclave peut être remis en service après analyse approfondie de la cause initiale. En cas d’échec persistant, une maintenance corrective approfondie est obligatoire (remplacement pièces défectueuses, ajustement paramètres, nettoyage circuits), suivie d’une requalification complète (QO + QP minimum) et d’une libération formelle par le responsable qualité ou organisme compétent.
Si des instruments de la charge suspecte ont déjà été utilisés, un rappel doit être organisé avec identification précise de tous les patients exposés, évaluation du risque infectieux par l’équipe hygiène et infectiologie, déclaration obligatoire aux autorités sanitaires selon les réglementations, et information transparente des patients concernés si l’évaluation de risque le justifie.
Documentation : Chaque incident fait l’objet d’un rapport détaillé incluant la description complète de l’événement avec chronologie, les résultats de l’investigation (causes identifiées), les actions correctives immédiates mises en œuvre, les actions préventives pour éviter la récurrence, l’évaluation de l’impact patient si applicable, et la notification aux équipes cliniques concernées. La mise à jour des procédures est réalisée si l’analyse révèle des lacunes dans les protocoles existants.
CHAPITRE 8: FORMATION DU PERSONNEL
8.1 Compétences requises
Le personnel du CSSD doit posséder un ensemble de compétences techniques, scientifiques et organisationnelles pour assurer la qualité et la sécurité du processus de stérilisation.
Personnel CSSD : Les compétences fondamentales incluent une connaissance approfondie de la microbiologie et des principes d’asepsie (modes de transmission, résistance microbienne, biofilms), la maîtrise complète des procédés de stérilisation (vapeur, ETO, H₂O₂, rayonnements), l’utilisation experte des équipements spécialisés (autoclaves diverses classes, laveurs-désinfecteurs, ultrasons), l’interprétation correcte des indicateurs et réponse appropriée aux alarmes, la gestion informatisée de la traçabilité avec logiciels spécialisés, et la gestion rigoureuse des stocks et péremptions selon les bonnes pratiques.
Formation initiale : La formation de base comprend un diplôme spécialisé en stérilisation dont la nature varie selon les pays (DU, certificat professionnel, formation qualifiante), une formation complète par le fabricant sur chaque équipement utilisé avec certification, des modules théoriques approfondis sur les normes ISO/EN et réglementations applicables, et un stage pratique supervisé de plusieurs semaines à mois dans un CSSD en activité.
Formation continue : L’actualisation des connaissances est obligatoire et comprend une mise à jour réglementaire annuelle sur les évolutions normatives et légales, une formation sur les nouvelles technologies et pratiques émergentes, des retours d’expérience structurés sur les incidents et actions correctives, et des audits internes qualité avec débriefing formatif. Un minimum de 20 à 40 heures annuelles de formation continue est généralement requis.
8.2 Certifications professionnelles
Les certifications professionnelles reconnues varient selon les régions mais témoignent toutes d’un niveau de compétence standardisé et vérifié.
Europe : Les formations incluent des Diplômes Universitaires (DU) de stérilisation hospitalière (France, 1 an, niveau Bac+3), des certifications nationales de technicien spécialisé (Allemagne, Sterilisationsassistent, 2-3 ans), et la certification du European Sterilization Committee (ESC) reconnue dans plusieurs pays.
USA : Les principales certifications américaines comprennent le CRCST (Certified Registered Central Service Technician) certification de base la plus répandue, le CIS (Certified Instrument Specialist) certification avancée délivrée par l’IAHCSMM, et le CSPDT (Certified Sterile Processing and Distribution Technician) certification de la CBSPD. Ces certifications nécessitent un examen et une recertification périodique.
Japon : La certification de la Japanese Society for Sterile Supply atteste des compétences selon les standards nationaux japonais, avec différents niveaux de qualification.
8.3 Procédures opératoires normalisées (SOP)
Les procédures opératoires normalisées constituent la référence documentaire obligatoire pour toutes les activités du CSSD. Elles garantissent la standardisation des pratiques et la conformité aux exigences réglementaires.
Documentation obligatoire : Le système documentaire comprend un manuel qualité CSSD définissant l’organisation, les responsabilités et la politique qualité, des SOP détaillées pour chaque type de charge avec paramètres, positionnement et contrôles spécifiques, les instructions complètes des fabricants d’équipements avec traductions certifiées, les protocoles d’utilisation de tous les indicateurs et tests de performance, les procédures d’urgence et de gestion des écarts avec arbres décisionnels, et les procédures de traçabilité et d’archivage conformes aux obligations légales.
Révision et mise à jour : Les procédures font l’objet d’une revue systématique annuelle minimum avec mise à jour si nécessaire, d’une révision immédiate après tout changement réglementation ou norme applicable, d’une actualisation suite à incident qualité avec intégration des leçons apprises, et d’une approbation formelle par le responsable qualité avec signature et datation. Un système de gestion documentaire électronique facilite la diffusion, l’accessibilité et le contrôle des versions.
CHAPITRE 9: EXEMPLES DE PRATIQUES INTERNATIONALES
9.1 Pratiques en Europe
Les pratiques européennes de stérilisation se caractérisent par une harmonisation normative importante tout en conservant des spécificités nationales dans l’organisation et le contrôle.
France : Le système français impose une certification obligatoire de la pharmacie centrale hospitalière responsable du CSSD pour les établissements de plus de 300 lits. Le Guide des bonnes pratiques publié par la SF2S (Société Française de Stérilisation) fait référence et est régulièrement mis à jour. Les contrôles qualité annuels doivent être réalisés par des organismes agréés COFRAC garantissant l’indépendance et la compétence technique. Le renforcement de la traçabilité suite à l’affaire Creutzfeldt-Jakob a conduit à l’obligation de traçabilité nominative patient pour certains dispositifs à risque. Les systèmes informatisés de gestion sont obligatoires pour les établissements de plus de 300 lits.
Exemple CHU Lyon : Le Centre Hospitalier Universitaire de Lyon illustre l’excellence française avec une stérilisation centralisée traitant plus de 50 000 cycles annuellement. La validation biologique est réalisée quotidiennement sur tous les autoclaves en activité. La traçabilité informatisée fonctionne en temps réel avec liaison directe entre le CSSD et les blocs opératoires. Le personnel bénéficie de 40 heures annuelles de formation continue obligatoire. L’établissement détient la certification ISO 9001 pour son service de stérilisation.
Allemagne : L’Allemagne applique les normes DIN EN avec une rigueur exemplaire. Les contrôles sont effectués par le TÜV (organisme de certification technique) selon des protocoles stricts. La formation du personnel est particulièrement développée avec un cursus de 3 ans obligatoire menant au diplôme de Sterilisationsassistent. La documentation exhaustive de tous les processus est une exigence culturelle autant que réglementaire.
Royaume-Uni : Le Royaume-Uni s’appuie sur les Health Technical Memorandum (HTM), particulièrement HTM 2010 spécifique à la stérilisation. La validation externe annuelle est obligatoire pour tous les établissements du NHS (National Health Service). Les audits NHS internes et externes vérifient régulièrement la conformité. La formation minimale exigée est le NVQ Level 3 (National Vocational Qualification) en stérilisation.
Suisse : La Suisse combine rigueur technique et pragmatisme. Le guide Swissmedic constitue la référence nationale avec des exigences parmi les plus strictes d’Europe. Les standards de la SSSH (Société Suisse de Stérilisation Hospitalière) complètent le dispositif. Les contrôles cantonaux sont réguliers et exigeants. La validation externe annuelle est obligatoire pour tous les stérilisateurs, réalisée par des organismes accrédités.
9.2 Pratiques aux États-Unis
Le système américain se caractérise par une approche pragmatique combinant exigences réglementaires fédérales et recommandations professionnelles largement suivies.
Cadre réglementaire : La FDA applique le 21 CFR Part 820 (Quality System Regulation) imposant des standards stricts de management qualité pour tous les fabricants et utilisateurs de dispositifs médicaux. Les CDC Guidelines constituent la référence nationale en matière de prévention des infections et de stérilisation, mises à jour régulièrement. Le standard AAMI ST79 « Comprehensive guide to steam sterilization » fait autorité et est considéré comme la bible de la stérilisation vapeur. L’accréditation Joint Commission est recherchée par la majorité des hôpitaux comme gage de qualité et d’excellence.
Exemple Mayo Clinic : La Mayo Clinic de Rochester (Minnesota) représente l’excellence américaine avec un CSSD centralisé de 80 000 pieds carrés (7400 m²). Plus de 450 000 instruments sont traités annuellement. Les systèmes automatisés de tracking par RFID permettent une traçabilité en temps réel de chaque instrument. Les tests biologiques quotidiens sont systématiques sur tous les stérilisateurs. L’intégration complète au dossier patient électronique assure une traçabilité nominative parfaite. La certification ISO 13485 garantit la conformité aux standards internationaux les plus exigeants.
Cleveland Clinic : Le système de la Cleveland Clinic illustre l’organisation en réseau avec 11 sites CSSD interconnectés. La standardisation complète des protocoles à travers tout le réseau assure une qualité homogène. Des dashboards qualité en temps réel permettent le monitoring simultané de tous les sites. La formation e-learning continue garantit l’actualisation permanente des compétences. Les audits qualité mensuels vérifient la conformité et identifient les opportunités d’amélioration.
Particularités USA : La surveillance biologique hebdomadaire constitue le minimum CDC, mais la pratique quotidienne est fortement recommandée et largement adoptée par les établissements d’excellence. La flash sterilization (stérilisation immédiate) est strictement encadrée avec protocoles spécifiques et justifications documentées. La libération paramétrique émerge progressivement dans les centres avancés disposant de systèmes de monitoring sophistiqués. L’adoption massive de technologies avancées comme les lecteurs rapides d’indicateurs biologiques (résultats en 1-3 heures) optimise les délais de libération.
9.3 Pratiques au Japon
Le Japon combine des exigences réglementaires strictes avec une culture de la qualité et de l’amélioration continue profondément ancrée.
Cadre réglementaire : La MHLW Ordinance 169 définit les exigences de système qualité pour les dispositifs médicaux, largement harmonisées avec ISO 13485 mais incluant des spécificités japonaises sur la documentation et la traçabilité. La PMDA (Pharmaceuticals and Medical Devices Agency) exerce une surveillance stricte avec des inspections régulières et détaillées. Les standards JIS (Japanese Industrial Standards) sont harmonisés avec les normes ISO mais peuvent présenter des exigences complémentaires. Les inspections obligatoires sont fréquentes et particulièrement rigoureuses.
Exemple Hôpital Universitaire de Tokyo : Le CSSD de l’Hôpital Universitaire de Tokyo illustre l’excellence technologique japonaise avec une installation ultramoderne de 2500 m². La robotisation partielle des tâches répétitives optimise l’efficacité et réduit les erreurs. La surveillance biologique quotidienne est standard sur tous les autoclaves. La traçabilité utilise des codes-barres 2D permettant une densité d’information élevée. La qualité vapeur fait l’objet de tests mensuels dépassant les exigences normatives annuelles. La culture kaizen (amélioration continue) s’applique systématiquement à tous les processus.
Spécificités japonaises : L’hyper-rigueur des procédures reflète la culture japonaise de la précision et de l’excellence. La documentation est méticuleuse avec enregistrement exhaustif de tous les paramètres et événements. Les technologies de pointe sont rapidement adoptées dès leur validation. La formation du personnel est longue et approfondie (2 à 4 ans) avec compagnonnage prolongé. Le mindset « zero-defect » (zéro défaut) guide toutes les activités. La maintenance préventive est intensive avec interventions fréquentes et remplacement préventif systématique des pièces d’usure.
Université de Kyoto – Innovation : L’Université de Kyoto développe des applications d’intelligence artificielle prédictive pour anticiper les pannes et optimiser les cycles. Des capteurs IoT multiples collectent des données en temps réel sur tous les paramètres. La maintenance prédictive utilise des algorithmes d’apprentissage automatique pour prévoir les défaillances. L’optimisation énergétique réduit la consommation de 30%. Les délais de traitement sont optimisés par planification intelligente des charges.
9.4 Comparaison synthétique
Tableau Comparatif International Détaillé :
| Aspect | Europe | USA | Japon |
|---|---|---|---|
| Formation personnel | Diplôme spécialisé (1-3 ans) | Certification IAHCSMM/CBSPD | Formation approfondie (2-4 ans) |
| Fréquence IB | Hebdomadaire (minimum) | Quotidienne recommandée | Quotidienne standard |
| Traçabilité | Informatisée obligatoire | RFID/code-barres avancé | Code-barres 2D systématique |
| Validation externe | Annuelle obligatoire | Joint Commission | PMDA inspections régulières |
| Coût annuel CSSD | 800-1200 €/lit | 1000-1500 $/bed | 120-180万円/bed |
| Technologie | Moderne, conforme normes | Très avancée, automation | Pointe, robotisation partielle |
CHAPITRE 10: TENDANCES ET INNOVATIONS
10.1 Technologies émergentes
L’évolution technologique transforme progressivement les pratiques de surveillance et de gestion de la stérilisation, apportant gains de productivité, amélioration de la traçabilité et réduction des risques.
Indicateurs intelligents : Les nouvelles générations d’indicateurs intègrent des puces RFID directement dans les emballages de stérilisation. Ces puces permettent une lecture automatique sans intervention manuelle, réduisant les erreurs de saisie. L’historique complet du cycle est conservé sur la puce avec tous les paramètres critiques. Les alertes de péremption sont automatisées avec notifications avant expiration. La traçabilité devient totalement automatisée depuis la préparation jusqu’à l’utilisation clinique.
Intelligence artificielle : Les applications d’IA en stérilisation se développent rapidement. La prédiction de pannes équipements utilise l’analyse de patterns pour identifier les signes précurseurs de défaillance. L’optimisation automatique des cycles ajuste les paramètres pour minimiser consommation énergétique et durée tout en maintenant l’efficacité. La détection précoce d’anomalies identifie les dérives avant qu’elles n’affectent la qualité. L’analyse big data de milliers de cycles révèle des corrélations et opportunités d’amélioration invisibles à l’analyse conventionnelle.
Connectivité IoT : Les autoclaves connectés au cloud permettent une surveillance distante en temps réel depuis n’importe quel terminal. Les alertes instantanées sur smartphones notifient immédiatement les responsables en cas d’anomalie. Les tableaux de bord interactifs agrègent les données de multiples sites pour une vision globale. La maintenance prédictive planifie automatiquement les interventions optimales. Les mises à jour logicielles s’effectuent à distance sans interruption de service.
10.2 Libération paramétrique
La libération paramétrique représente une évolution majeure du concept de validation de stérilisation, permettant une libération des charges basée uniquement sur les paramètres physiques mesurés.
Concept : La libération paramétrique consiste à valider l’efficacité de stérilisation exclusivement sur la base des paramètres physiques enregistrés (température, pression, temps), sans attendre les résultats d’indicateurs biologiques qui nécessitent 24-48 heures d’incubation. Cette approche repose sur une validation extensive démontrant la corrélation parfaite entre paramètres et efficacité létale. Les exigences de validation sont très strictes avec démonstrations répétées et documentation exhaustive. L’approbation des autorités sanitaires est obligatoire avant mise en œuvre. La réduction spectaculaire des délais de disponibilité des instruments constitue l’avantage majeur.
Conditions d’application : La libération paramétrique n’est envisageable que dans des conditions très strictes : historique qualité irréprochable sur plusieurs années sans échec de stérilisation, capteurs redondants calibrés avec traçabilité métrologique impeccable, validation extensive dépassant largement les exigences conventionnelles, approbation formelle des autorités sanitaires compétentes, et maintien obligatoire de la surveillance biologique hebdomadaire minimum pour vérification continue.
Avantages : La disponibilité immédiate des instruments après refroidissement optimise la gestion des flux et réduit les stocks nécessaires. L’optimisation des flux CSSD améliore la productivité globale. La réduction des stocks d’instruments libère des investissements. L’amélioration de l’efficience génère des économies significatives à long terme.
Limitations : L’investissement initial élevé en équipements sophistiqués et validation extensive constitue un frein pour de nombreux établissements. La complexité de la validation nécessite une expertise de haut niveau. La maintenance intensive des systèmes de monitoring est impérative. L’acceptation réglementaire demeure variable selon les pays et autorités.
10.3 Développement durable
Les préoccupations environnementales influencent progressivement les pratiques de stérilisation avec recherche d’efficience énergétique et réduction des déchets.
Éco-stérilisation : Les autoclaves nouvelle génération affichent des performances énergétiques améliorées avec classification classe A selon standards européens. Les systèmes de récupération de chaleur des condensats valorisent l’énergie thermique résiduelle pour préchauffage de l’eau ou chauffage des locaux. La réduction de consommation d’eau atteint 30 à 50% grâce à des circuits optimisés et recyclage partiel. Les cycles basse température émergents pour matériaux thermosensibles réduisent les besoins énergétiques.
Emballages durables : Les conteneurs rigides réutilisables sont privilégiés pour les sets à rotation rapide, éliminant des milliers de sachets jetables. Les matériaux recyclables remplacent progressivement les plastiques non recyclables. Les programmes de réduction des déchets plastiques s’intensifient dans tous les pays développés. L’analyse de cycle de vie des produits guide les choix vers les solutions les plus durables.
Optimisation ressources : La planification intelligente des cycles avec algorithmes d’optimisation maximise le taux de remplissage. Le regroupement de charges compatibles réduit le nombre de cycles nécessaires. La minimisation des cycles à vide par programmation anticipée des besoins économise énergie et eau. Les programmes de sensibilisation des équipes développent une culture de responsabilité environnementale.
CONCLUSION
La surveillance de la stérilisation à la vapeur constitue un élément fondamental de la sécurité des patients dans tous les établissements de santé à travers le monde. Ce guide complet a mis en évidence la complexité et la rigueur nécessaires pour garantir l’efficacité des processus de stérilisation dans un environnement médical en constante évolution.
Les professionnels de la stérilisation font face à des défis multiples : maîtrise de technologies sophistiquées, respect de réglementations de plus en plus strictes, gestion de la traçabilité exhaustive, optimisation des flux et des ressources, et maintien d’une culture qualité irréprochable. La convergence internationale des pratiques, portée par l’harmonisation des normes ISO et l’échange d’expériences, élève continuellement le niveau d’exigence.
Points clés essentiels à retenir :
- Surveillance multi-niveaux indispensable : Les indicateurs biologiques (étalon-or) doivent être utilisés au minimum hebdomadairement, idéalement quotidiennement. Les indicateurs chimiques valident chaque charge avec classes appropriées selon ISO 11140. Le monitoring mécanique continu fournit la traçabilité objective. Les tests physiques quotidiens (Bowie-Dick, étanchéité) assurent le bon fonctionnement.
- Conformité réglementaire stricte : Les normes ISO 17665 et EN 285/13060 définissent les exigences techniques en Europe. La FDA, le CDC et l’AAMI établissent les standards aux États-Unis. Le MHLW et la PMDA régulent le Japon avec rigueur. L’harmonisation internationale progresse mais des spécificités nationales persistent.
- Qualité vapeur critique : La siccité minimale de 0,95 est obligatoire pour efficacité optimale. Les gaz incondensables doivent rester sous 3,5% pour éviter les poches froides. Les tests annuels EN 285 vérifient ces paramètres essentiels. L’impact direct sur l’efficacité justifie une attention particulière.
- Validation rigoureuse obligatoire : La qualification suit le triptyque Installation/Opérationnelle/Performance (IQ/OQ/PQ). Les protocoles standardisés garantissent la reproductibilité et la conformité. La revalidation annuelle minimum maintient la conformité dans le temps. La documentation exhaustive permet la traçabilité et les audits.
- Organisation CSSD structurée : La séparation stricte des zones (sale/propre/stérile) prévient les contaminations croisées. Le flux unidirectionnel obligatoire évite les retours en arrière. La traçabilité informatisée bidirectionnelle (ascendante/descendante) assure la sécurité patient. La formation spécialisée du personnel garantit la compétence technique.
- Maintenance préventive intensive : Les contrôles quotidiens, hebdomadaires et mensuels préviennent les pannes. L’étalonnage régulier de l’instrumentation maintient la fiabilité des mesures. L’intervention rapide en cas d’écart limite les conséquences. La culture d’amélioration continue optimise les performances.
- Pratiques internationales convergentes : Les standards techniques sont largement harmonisés au niveau mondial. Les exigences qualité élevées se généralisent dans tous les pays développés. Le partage international des bonnes pratiques accélère les progrès. Les innovations technologiques se diffusent rapidement.
Les évolutions futures s’annoncent prometteuses avec l’intégration croissante des technologies numériques. Les innovations en intelligence artificielle permettront une optimisation continue des processus et une détection précoce des anomalies. L’Internet des Objets (IoT) apportera une connectivité totale et un monitoring en temps réel multi-sites. Les systèmes RFID généraliseront la traçabilité automatisée sans intervention humaine. La libération paramétrique, bien qu’encore limitée, représente une avancée majeure pour l’efficience des CSSD.
Le développement durable devient également une préoccupation centrale avec des équipements éco-énergétiques, l’optimisation des consommations, et la réduction des déchets. Les autoclaves nouvelle génération consomment 30 à 50% moins d’eau et d’énergie tout en offrant des performances supérieures. Les emballages réutilisables remplacent progressivement les consommables jetables. L’optimisation des flux réduit le nombre de cycles nécessaires et l’empreinte environnementale.
Responsabilité collective et engagement :
La stérilisation efficace repose sur l’engagement coordonné de tous les acteurs de la chaîne :
- Direction des établissements : Investissements suffisants en équipements performants, formation continue du personnel, soutien à la culture qualité, et allocation de ressources appropriées.
- Responsables CSSD : Organisation rigoureuse des processus, supervision technique constante, management des équipes, et pilotage de l’amélioration continue.
- Personnel technique : Rigueur et professionnalisme quotidien, respect scrupuleux des procédures, vigilance constante, et remontée immédiate des anomalies.
- Équipes cliniques : Respect des règles d’utilisation des dispositifs, retour d’information sur incidents, participation aux revues de processus, et collaboration active avec le CSSD.
- Autorités sanitaires : Surveillance appropriée des établissements, mise à jour régulière des réglementations, soutien à la recherche et l’innovation, et diffusion des bonnes pratiques.
La surveillance de la stérilisation à la vapeur n’est pas une option mais une obligation légale, éthique et professionnelle absolue. Chaque écart aux protocoles établis représente un risque potentiel pour la vie des patients. La rigueur méthodique, la formation continue approfondie, et l’utilisation appropriée de tous les moyens de surveillance disponibles constituent les garants incontournables de la sécurité et de la qualité des soins dans nos établissements de santé modernes.
L’excellence en stérilisation ne s’improvise pas : elle se construit patiemment, jour après jour, cycle après cycle, avec la conviction profonde et inébranlable que chaque instrument correctement stérilisé contribue directement à sauver des vies et à prévenir les infections nosocomiales. C’est cette exigence de tous les instants qui fait la différence entre une pratique routinière et une véritable culture de la qualité et de la sécurité.