GUIDE COMPLET DES DISPOSITIFS MÉDICAUX : RÉGLEMENTATION UE 2017/745, CLASSIFICATION ET INNOVATIONS 2024
Version 2024
Guide de référence pour les professionnels de santé, fabricants et organismes de certification
Table des Matières
- Introduction
- Chapitre 1 : Cadre Réglementaire Européen
- 1.1 Règlement UE 2017/745 (MDR)
- 1.2 Transition depuis les anciennes directives
- 1.3 Réglementation française (ANSM)
- 1.4 Marquage CE et conformité
- Chapitre 2 : Classification Réglementaire
- 2.1 Système de classification basé sur les risques
- 2.2 Classes I, IIa, IIb, III
- 2.3 Règles de classification (Annexe VIII du MDR)
- 2.4 Critères de classification
- 2.5 Exemples pratiques
- Chapitre 3 : Catégories d’Utilisation
- 3.1 Dispositifs non invasifs
- 3.2 Dispositifs invasifs
- 3.3 Dispositifs actifs
- 3.4 Dispositifs implantables
- 3.5 Dispositifs de mesure
- 3.6 Systèmes et packs de procédure
- Chapitre 4 : Dispositifs Médicaux Implantables Actifs (DMIA)
- 4.1 Définition et spécificités
- 4.2 Réglementation spécifique
- 4.3 Procédures d’évaluation
- 4.4 Exemples et applications
- Chapitre 5 : Innovations Technologiques 2024
- 5.1 Robotique chirurgicale : da Vinci 5
- 5.2 Intelligence artificielle en médecine
- 5.3 Bio-impression 3D
- 5.4 Technologies émergentes
- Chapitre 6 : Exigences Réglementaires par Classe
- Chapitre 7 : Perspectives d’Avenir
- Conclusion et Annexes
Introduction
Les dispositifs médicaux constituent un secteur économique majeur représentant plus de 500 milliards d’euros au niveau mondial. En Europe, ce marché emploie plus de 760 000 personnes et génère un chiffre d’affaires de 140 milliards d’euros annuellement. Ces technologies médicales, allant du simple pansement aux robots chirurgicaux les plus sophistiqués, jouent un rôle crucial dans l’amélioration de la santé publique et la qualité de vie des patients.
L’entrée en vigueur du Règlement européen 2017/745 (MDR) en mai 2021 a profondément transformé le paysage réglementaire des dispositifs médicaux. Cette nouvelle réglementation, plus stricte que les anciennes directives, vise à renforcer la sécurité des patients tout en stimulant l’innovation médicale.
Enjeux majeurs :
- Sécurité renforcée pour les patients
- Traçabilité améliorée des dispositifs
- Surveillance post-commercialisation obligatoire
- Classification plus précise selon les risques
- Intégration des nouvelles technologies (IA, robotique, bio-impression)
Ce guide propose une approche complète de la réglementation actuelle, intégrant les dernières innovations technologiques de 2024 et leurs implications réglementaires. Il s’adresse aux professionnels de santé, fabricants, organismes notifiés et autorités compétentes impliqués dans le développement, la certification et l’utilisation des dispositifs médicaux.

Chapitre 1 : Cadre Réglementaire Européen
1.1 Règlement UE 2017/745 (MDR)
Le Règlement européen 2017/745 relatif aux dispositifs médicaux, communément appelé MDR (Medical Device Regulation), constitue le cadre réglementaire de référence pour tous les dispositifs médicaux commercialisés dans l’Union européenne depuis le 26 mai 2021.
Objectifs principaux du MDR :
- Renforcement de la sécurité : Évaluation clinique plus rigoureuse, surveillance post-commercialisation obligatoire
- Amélioration de la transparence : Base de données européenne EUDAMED, identification unique des dispositifs (UDI)
- Harmonisation européenne : Règles communes pour tous les États membres
- Adaptation aux innovations : Prise en compte des logiciels, nanomatériaux, dispositifs connectés
Structure du règlement :
- Chapitre I : Dispositions générales
- Chapitre II : Mise à disposition sur le marché et mise en service
- Chapitre III : Identification et traçabilité des dispositifs
- Chapitre IV : Organismes notifiés
- Chapitre V : Classification et évaluation de la conformité
- Chapitre VI : Évaluation clinique et investigations cliniques
- Chapitre VII : Surveillance post-commercialisation et vigilance
1.2 Transition depuis les anciennes directives
Le MDR remplace progressivement les anciennes directives européennes :
| Ancienne réglementation | Nouvelle réglementation | Date de transition |
|---|---|---|
| Directive 90/385/CEE (DMIA) | Règlement UE 2017/745 (MDR) | 26 mai 2021 |
| Directive 93/42/CEE (DM) | 26 mai 2021 | |
| Directive 98/79/CE (DMDIV) | Règlement UE 2017/746 (IVDR) | 26 mai 2022 |
Dispositions transitoires :
Attention : Les dispositifs certifiés sous l’ancienne réglementation bénéficient de périodes transitoires limitées :
- Classe III et implantables : jusqu’en mai 2024
- Autres classes : jusqu’en mai 2025
- Renouvellement obligatoire sous MDR après ces dates
1.3 Réglementation française (ANSM)
L’Agence nationale de sécurité du médicament et des produits de santé (ANSM) est l’autorité compétente française pour les dispositifs médicaux. Elle assure la transposition du règlement européen dans le droit national français.
Missions de l’ANSM :
- Surveillance du marché français des dispositifs médicaux
- Matériovigilance et gestion des incidents
- Contrôle des organismes notifiés français
- Autorisation des investigations cliniques
- Information des professionnels de santé
Transposition en droit français :
Le Code de la santé publique (articles L.5211-1 et suivants, R.5211-1 et suivants) transpose les dispositions européennes et précise certaines modalités d’application spécifiques à la France.
1.4 Marquage CE et conformité
Le marquage CE est obligatoire pour tous les dispositifs médicaux mis sur le marché européen (sauf dispositifs sur-mesure et d’investigation clinique).
Procédure d’obtention du marquage CE :
- Classification du dispositif selon l’Annexe VIII du MDR
- Évaluation de la conformité selon la procédure appropriée (Annexes IX à XI)
- Intervention d’un organisme notifié (classes IIa, IIb, III)
- Déclaration de conformité établie par le fabricant
- Apposition du marquage CE sur le dispositif et l’emballage
- Enregistrement dans la base de données EUDAMED
Chapitre 2 : Classification Réglementaire
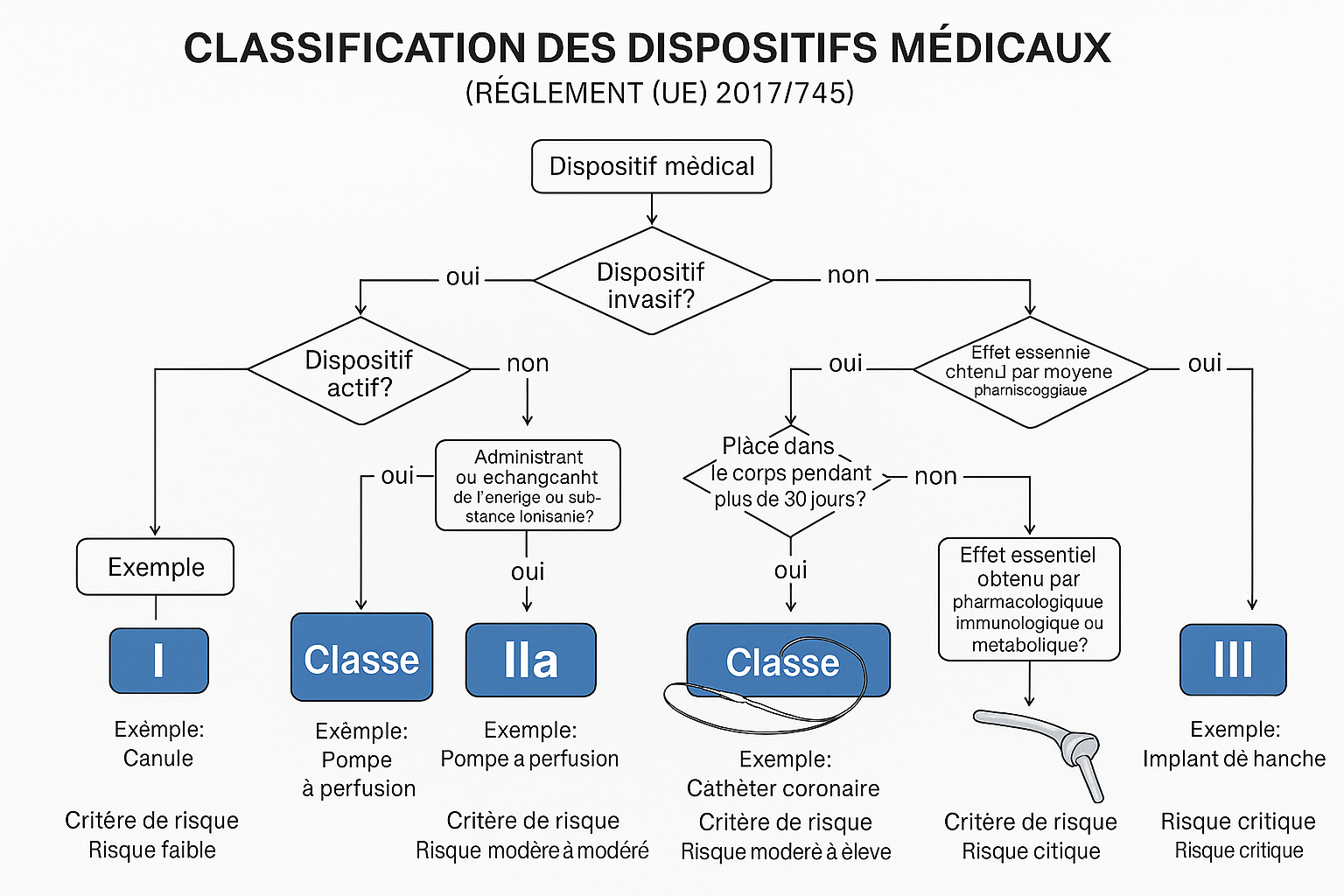
2.1 Système de classification basé sur les risques
La classification des dispositifs médicaux repose sur une approche fondée sur l’évaluation des risques pour le patient et l’utilisateur. Cette méthode, harmonisée au niveau international, prend en compte plusieurs critères déterminants.
Critères de classification :
- Vulnérabilité du corps humain : Selon la partie du corps concernée
- Invasivité : Pénétration dans le corps par orifice naturel ou artificiel
- Durée d’utilisation : Transitoire, court terme, long terme
- Localisation anatomique : Contact avec système nerveux central, circulatoire
- Source d’énergie : Dispositifs actifs ou passifs
- Effet systémique : Local ou généralisé
2.2 Classes I, IIa, IIb, III avec sous-classifications
| Classe | Niveau de risque | Exemples | Organisme notifié requis |
|---|---|---|---|
| Classe I | Risque faible | Pansements, lunettes, fauteuils roulants | Non |
| Classe IIa | Risque modéré | Lentilles de contact, appareils auditifs | Oui |
| Classe IIb | Risque élevé | Respirateurs, défibrillateurs externes | Oui |
| Classe III | Risque très élevé | Implants cardiaques, prothèses de hanche | Oui |
Sous-classifications pour la Classe I :
La Classe I se subdivise en trois sous-catégories spécifiques selon l’article 52(7) du MDR :
Classe Is – Dispositifs stériles :
- Caractéristiques : Fournis stériles ou avec indication de stérilisation
- Exigences supplémentaires : Validation procédé de stérilisation, emballage stérile
- Organisme notifié : Requis pour aspects liés à la stérilisation uniquement
- Exemples : Compresses stériles, pansements stériles, gants chirurgicaux stériles, seringues stériles
- Normes applicables : ISO 11137 (stérilisation), ISO 11607 (emballages stériles)
Classe Im – Dispositifs avec fonction de mesure :
- Caractéristiques : Mesure quantitative de paramètres physiologiques ou substances
- Critères de mesure :
- Affichage en unités légales (Directive 80/181/CEE)
- Exactitude revendiquée explicitement ou implicitement
- Impact potentiel sur santé patient si erreur de mesure
- Exigences supplémentaires : Validation métrologique, étalonnage, traçabilité mesures
- Organisme notifié : Requis pour aspects métrologiques uniquement
- Exemples : Thermomètres médicaux, tensiomètres manuels, balances médicales, seringues graduées
- Normes applicables : EN 12470 (thermomètres), EN 1060 (sphygmomanomètres)
Classe Ir – Instruments chirurgicaux réutilisables :
- Caractéristiques : Usage chirurgical, non connectés à dispositif actif, réutilisables
- Fonctions : Couper, forer, scier, gratter, racler, serrer, rétracter, clipper
- Exigences supplémentaires :
- Instructions retraitement (nettoyage, désinfection, stérilisation)
- Validation cycles de retraitement
- Résistance à la corrosion et usure
- Nombre maximum de réutilisations
- Organisme notifié : Requis pour certification CE
- Exemples : Ciseaux chirurgicaux, pinces, scalpels réutilisables, curettes, écarteurs
- Normes applicables : ISO 7153 (instruments chirurgicaux métalliques), ISO 17664 (retraitement)
Tableau comparatif des sous-classes I :
| Aspect | Classe I standard | Classe Is | Classe Im | Classe Ir |
|---|---|---|---|---|
| Organisme notifié | Non | Oui (stérilisation) | Oui (métrologie) | Oui (complet) |
| Déclaration CE | Auto-certification | Certification partielle | Certification partielle | Certification complète |
| Surveillance post-marché | Rapport PMS | Rapport PMS | Rapport PMS | Rapport PMS |
| Exigences spécifiques | Basiques | Validation stérilisation | Validation métrologique | Instructions retraitement |
| Durée validité certificat | Illimitée | 5 ans | 5 ans | 5 ans |
2.3 Règles de classification (Annexe VIII du MDR)
L’Annexe VIII du MDR définit 22 règles de classification réparties en quatre catégories principales :
Dispositifs non invasifs (Règles 1 à 4) :
- Règle 1 : Contact avec peau intacte ou absence de contact → Classe I
- Règle 2 : Canalisation ou stockage pour administration → Classe IIa ou IIb
- Règle 3 : Modification composition biologique → Classe III
- Règle 4 : Contact avec peau ou muqueuse lésée → Classe IIa
Dispositifs invasifs (Règles 5 à 8) :
- Règle 5 : Invasifs par orifice naturel → Classes I, IIa, IIb selon durée
- Règle 6 : Invasifs chirurgicaux transitoires → Classes I, IIa, IIb
- Règle 7 : Invasifs chirurgicaux court terme → Classes IIa, IIb, III
- Règle 8 : Implantables et invasifs long terme → Classes IIa, IIb, III
Dispositifs actifs (Règles 9 à 13) :
- Règle 9 : Thérapeutiques administrant énergie → Classes IIa, IIb
- Règle 10 : Diagnostic et surveillance → Classes IIa, IIb
- Règle 11 : Logiciels → Classes I, IIa, IIb selon impact décisionnel
- Règle 12 : Administration substances → Classes I, IIa, IIb
- Règle 13 : Autres dispositifs actifs → Classe I
Règles spéciales (Règles 14 à 22) :
- Règle 14 : Dispositifs incorporant médicament → Classe III
- Règle 15 : Contraception et MST → Classes IIa, IIb, III
- Règle 16 : Désinfection/stérilisation → Classes IIa, IIb
- Règles 17-22 : Imagerie, tissus d’origine biologique, etc.
2.4 Critères de classification
Durée d’utilisation :
- Transitoire : Moins de 60 minutes
- Court terme : Entre 60 minutes et 30 jours
- Long terme : Plus de 30 jours
Invasivité :
- Non invasif : Contact avec peau intacte uniquement
- Invasif par orifice : Pénétration par orifice naturel
- Chirurgicalement invasif : Pénétration par ouverture artificielle
Localisation anatomique critique :
- Système nerveux central : Cerveau, méninges, moelle épinière
- Système circulatoire central : Cœur, artères principales, veines caves
- Autres localisations : Selon impact potentiel
2.5 Exemples pratiques par classe
Classe I – Exemples détaillés par sous-classe :
Classe I standard :
| Dispositif | Justification classification | Règle MDR |
|---|---|---|
| Pansements adhésifs non stériles | Contact peau intacte, non invasif, non stérile | Règle 1 |
| Fauteuils roulants | Aucun contact avec patient, aide mobilité | Règle 1 |
| Lunettes correctrices | Contact indirect, correction défaut visuel | Règle 1 |
| Béquilles, cannes | Aide à la marche, contact externe uniquement | Règle 1 |
Classe Is (stériles) :
| Dispositif | Justification classification | Exigences spécifiques |
|---|---|---|
| Compresses stériles | Contact peau lésée, fourni stérile | Validation stérilisation γ ou ETO |
| Gants chirurgicaux stériles | Contact surfaces stériles, fourni stérile | Tests intégrité, biocompatibilité |
| Seringues stériles jetables | Contact avec médicaments stériles | Stérilisation ETO, emballage stérile |
| Cathéters urinaires stériles | Invasif orifice naturel, court terme | Biocompatibilité, stérilité garantie |
Classe Im (mesure) :
| Dispositif | Paramètre mesuré | Exigences métrologiques |
|---|---|---|
| Thermomètres médicaux | Température corporelle (°C) | Précision ±0,1°C, étalonnage |
| Balances médicales | Poids corporel (kg) | Classe III OIML, vérification périodique |
| Seringues graduées | Volume médicament (mL) | Précision volumétrique, traçabilité |
| Tensiomètres manuels | Pression artérielle (mmHg) | Précision ±3 mmHg, étalonnage |
Classe Ir (réutilisables chirurgicaux) :
| Dispositif | Fonction chirurgicale | Exigences retraitement |
|---|---|---|
| Ciseaux chirurgicaux | Couper tissus, fils | Instructions nettoyage, stérilisation vapeur |
| Pinces anatomiques | Saisir, manipuler tissus | Résistance corrosion, 500 cycles min |
| Écarteurs chirurgicaux | Rétracter, maintenir ouverture | Validation fatigue mécanique |
| Curettes gynécologiques | Gratter, racler muqueuses | Biocompatibilité, instructions précises |
Classe IIa – Exemples détaillés :
- Lentilles de contact : Invasif orifice naturel, court terme
- Appareils auditifs : Invasif conduit auditif, long terme
- Cathéters urinaires : Invasif urètre, court terme
- Seringues avec médicament : Administration substance
Classe IIb – Exemples détaillés :
- Défibrillateurs externes : Énergie potentiellement dangereuse
- Ventilateurs : Surveillance paramètres vitaux critiques
- Cathéters centraux : Contact système circulatoire central
- Préservatifs : Prévention MST
Classe III – Exemples détaillés :
- Stents coronaires : Implantable, système circulatoire central
- Prothèses de hanche : Implant articulaire, long terme
- Valves cardiaques : Implantable, système circulatoire central
- Implants mammaires : Règle spéciale 8
Chapitre 3 : Catégories d’Utilisation
3.1 Dispositifs non invasifs
Les dispositifs non invasifs représentent la majorité des dispositifs médicaux en volume. Ils se caractérisent par l’absence de pénétration dans le corps humain, ne touchant que la peau intacte ou n’ayant aucun contact avec le patient.
Caractéristiques principales :
- Contact limité à la peau intacte
- Pas de pénétration corporelle
- Généralement classe I (risque faible)
- Procédures de certification simplifiées
Sous-catégories :
| Catégorie | Description | Exemples | Classe typique |
|---|---|---|---|
| Dispositifs externes | Aucun contact patient | Fauteuils roulants, béquilles | I |
| Contact peau intacte | Contact superficiel | Électrodes ECG, pansements | I |
| Canalisation/stockage | Pour fluides corporels | Poches de sang, tubulures | IIa/IIb |
| Modification biologique | Altération composition | Dialyseurs, oxygénateurs | III |
3.2 Dispositifs invasifs
Les dispositifs invasifs pénètrent dans le corps humain soit par un orifice naturel, soit par une ouverture créée chirurgicalement. Leur classification dépend de la voie d’accès, de la durée d’utilisation et de la localisation anatomique.
Classification par voie d’accès :
Invasifs par orifice naturel :
- Orifices concernés : Bouche, nez, oreilles, yeux, urètre, vagin, anus
- Classification : Selon durée et localisation finale
- Exemples : Sondes gastriques, cathéters urinaires, endoscopes
Chirurgicalement invasifs :
- Caractéristique : Pénétration par ouverture artificielle
- Ouvertures : Incisions, ponctions, perforations
- Classification : Généralement classe supérieure
- Exemples : Cathéters centraux, drains, implants
Impact de la durée d’utilisation :
Règle générale : Plus la durée d’utilisation est longue, plus la classification tend vers une classe élevée.
- Transitoire (< 60 min) : Classification minimale
- Court terme (60 min – 30 jours) : Classification intermédiaire
- Long terme (> 30 jours) : Classification maximale
3.3 Dispositifs actifs
Un dispositif actif dépend d’une source d’énergie autre que celle générée par le corps humain ou la gravité. Cette énergie peut être électrique, pneumatique, hydraulique, ou autre.
Types d’énergie :
- Électrique : Appareils électroniques, stimulateurs
- Pneumatique : Ventilateurs, compresseurs
- Hydraulique : Systèmes de pompage
- Mécanique : Moteurs, ressorts pré-chargés
- Rayonnement : Lasers, radiographie
- Chimique : Réactions exothermiques
Classification des dispositifs actifs :
| Type | Fonction | Classe typique | Exemples |
|---|---|---|---|
| Thérapeutiques | Administration énergie | IIa/IIb | Électrochirurgie, lasers |
| Diagnostic | Surveillance, mesure | IIa/IIb | Échographes, ECG |
| Logiciels | Traitement information | I/IIa/IIb | IA diagnostique, PACS |
| Administration substances | Délivrance contrôlée | I/IIa/IIb | Pompes perfusion |
3.4 Dispositifs implantables
Les dispositifs implantables sont destinés à être introduits totalement dans le corps humain ou à remplacer une surface épithéliale ou oculaire, et à y demeurer après la procédure d’implantation.
Critères d’implantabilité :
- Introduction totale : Entièrement dans le corps
- Remplacement de surface : Épithélium, surface oculaire
- Durée minimale : 30 jours pour les dispositifs partiellement introduits
- Intervention clinique : Procédure médicale nécessaire
Types d’implants :
Implants passifs :
- Orthopédiques : Prothèses articulaires, plaques, vis
- Cardiovasculaires : Stents, valves mécaniques
- Esthétiques : Implants mammaires, implants faciaux
- Dentaires : Implants dentaires, couronnes
Implants actifs (DMIA) :
- Cardiaques : Pacemakers, défibrillateurs
- Neurologiques : Neurostimulateurs, implants cochléaires
- Autres : Pompes implantables, capteurs
Exigences spécifiques :
Obligations pour les implants :
- Carte d’implant obligatoire
- Information patient renforcée
- Traçabilité UDI
- Évaluation clinique pré-commercialisation
- Surveillance post-commercialisation renforcée
3.5 Dispositifs de mesure
Les dispositifs avec fonction de mesure fournissent des informations quantitatives sur des paramètres physiologiques, anatomiques ou sur des substances administrées ou prélevées.
Critères de fonction de mesure :
- Mesure quantitative : Paramètres physiologiques ou substances
- Unités légales : Affichage en unités reconnues
- Exactitude requise : Impact sur diagnostic/traitement
Types de mesures :
| Catégorie | Paramètres mesurés | Exemples | Classe |
|---|---|---|---|
| Paramètres vitaux | Pression, température, fréquence | Tensiomètres, thermomètres | Im |
| Volumes/débits | Volumes corporels, débits | Spiromètres, débitmètres | Im/IIa |
| Substances | Médicaments, fluides | Seringues graduées | Im |
| Paramètres complexes | Surveillance continue | Moniteurs multiparamètres | IIa/IIb |
3.6 Systèmes et packs de procédure
L’article 22 du MDR définit les règles applicables aux systèmes et packs de procédure, combinaisons de dispositifs utilisées ensemble pour un usage médical spécifique.
Définitions :
- Pack de procédure : Combinaison de produits emballés ensemble et mis sur le marché pour un usage médical spécifique
- Système : Combinaison de produits, emballés ensemble ou non, destinés à être interconnectés ou combinés pour un usage médical spécifique
Règles de classification :
- Composants conformes : Classification selon l’usage prévu du système/pack
- Composants non conformes : Le système devient un dispositif à part entière
- Classe résultante : Généralement la plus haute classe des composants
Exemples pratiques :
- Packs chirurgicaux : Combinaison d’instruments pour intervention spécifique
- Systèmes de perfusion : Pompe + tubulures + cathéter
- Kits de diagnostic : Dispositifs + réactifs pour test spécifique
Chapitre 4 : Dispositifs Médicaux Implantables Actifs (DMIA)

4.1 Définition et spécificités
Les Dispositifs Médicaux Implantables Actifs (DMIA) constituent une catégorie particulière de dispositifs médicaux combinant les caractéristiques d’un implant et d’un dispositif actif. Ils représentent l’une des technologies médicales les plus sophistiquées et critiques pour la santé des patients.
Caractéristiques distinctives :
- Implantabilité : Destiné à être introduit totalement ou partiellement dans le corps
- Activité : Fonctionnement dépendant d’une source d’énergie externe
- Autonomie : Fonctionnement indépendant après implantation
- Longévité : Durée de vie généralement supérieure à 5 ans
- Criticité : Souvent vitaux pour le patient
Classification systématique :
Tous les DMIA sont automatiquement classés en Classe III, représentant le niveau de risque le plus élevé dans la classification des dispositifs médicaux.
4.2 Réglementation spécifique
Les DMIA sont soumis aux dispositions du Règlement UE 2017/745, avec des exigences particulièrement strictes en raison de leur criticité.
Exigences essentielles spécifiques :
- Sécurité électrique : Protection contre les chocs, interférences électromagnétiques
- Biocompatibilité : Matériaux compatibles pour implantation long terme
- Fiabilité : Taux de défaillance minimal, durée de vie prolongée
- Programmabilité : Sécurité des systèmes de programmation externe
- Identification : Traçabilité complète du dispositif
Normes harmonisées applicables :
| Norme | Domaine | Application |
|---|---|---|
| EN 45502-2-1 | Implants cardiaques actifs | Pacemakers, défibrillateurs |
| EN 45502-2-3 | Implants cochléaires | Prothèses auditives implantables |
| ISO 14708 | Série sur les implants actifs | Exigences générales et spécifiques |
| IEC 60601-2-31 | Moniteurs ECG externes | Compatibilité avec implants |
4.3 Procédures d’évaluation de la conformité
Les DMIA suivent des procédures d’évaluation de la conformité particulièrement rigoureuses, impliquant obligatoirement un organisme notifié.
Procédures applicables :
- Annexe II : Documentation technique complète
- Annexe IX : Système qualité complet + examen de conception
- Annexe X : Examen de type + vérification conformité
- Annexe XI : Vérification conformité basée sur assurance qualité
Étapes d’évaluation :
- Évaluation préclinique : Tests laboratoire, biocompatibilité, durabilité
- Évaluation clinique : Investigation clinique obligatoire
- Analyse des risques : ISO 14971, analyse FMEA/FMECA
- Audit système qualité : ISO 13485, inspection organisme notifié
- Examen conception : Dossier technique, revue par experts
- Surveillance continue : Audits périodiques, mise à jour dossier
Évaluation clinique renforcée :
Exigences cliniques pour DMIA :
- Investigation clinique pré-commercialisation obligatoire
- Suivi clinique post-commercialisation sur 5-10 ans minimum
- Évaluation par panel d’experts (consultation procédure Article 54)
- Rapport périodique de sécurité (PSUR)
- Résumé des données de sécurité et performance clinique (SSCP)
4.4 Exemples et applications
Implants cardiovasculaires :
Stimulateurs cardiaques (Pacemakers) :
- Fonction : Stimulation électrique du muscle cardiaque
- Types : Simple/double chambre, resynchronisation, sans sonde
- Durée de vie : 7-15 ans selon modèle et usage
- Technologies 2024 : Miniaturisation, télémédecine, IA prédictive
Défibrillateurs automatiques implantables (DAI) :
- Fonction : Détection et traitement arythmies graves
- Modes : Défibrillation, cardioversion, stimulation anti-tachycardie
- Indications : Prévention mort subite, cardiomyopathies
- Évolutions : Algorithmes adaptatifs, réduction chocs inappropriés
Implants neurologiques :
Neurostimulateurs :
- Applications : Douleur chronique, Parkinson, épilepsie, dépression
- Types : Stimulation médullaire, cérébrale profonde, vague, occipitale
- Programmation : Paramètres ajustables par télémétrie
- Innovation 2024 : Stimulation en boucle fermée, capteurs intégrés
Implants cochléaires :
- Fonction : Restauration auditive par stimulation électrique
- Composants : Partie interne implantée + processeur externe
- Candidats : Surdités profondes, échec prothèses classiques
- Progrès : Electrodes précourbées, préservation audition résiduelle
Autres DMIA innovants :
| Dispositif | Application | Innovation 2024 | Statut réglementaire |
|---|---|---|---|
| Cœur artificiel total | Insuffisance cardiaque terminale | Miniaturisation, autonomie | Classe III, essais cliniques |
| Pancréas artificiel | Diabète type 1 | Algorithmes prédictifs | Système, classe IIb/III |
| Implants rétiniens | Cécité, dégénérescence | Résolution améliorée | Classe III, développement |
| Neurostimulateurs connectés | Troubles neurologiques | IA, télémédecine | Classe III, évaluation |
Défis réglementaires spécifiques :
Enjeux majeurs pour les DMIA :
- Cybersécurité : Protection contre piratage, mise à jour sécurisée
- Interopérabilité : Communication avec autres dispositifs médicaux
- Intelligence artificielle : Algorithmes adaptatifs, validation clinique
- Télémonitorage : Transmission données, protection vie privée
- Obsolescence : Support long terme, migration technologique
Chapitre 5 : Innovations Technologiques 2024
5.1 Robotique chirurgicale : système da Vinci 5
L’année 2024 marque une étape majeure dans l’évolution de la robotique chirurgicale avec l’introduction du système da Vinci 5 d’Intuitive Surgical, représentant une avancée technologique significative par rapport aux générations précédentes.
Caractéristiques techniques du da Vinci 5 :
- Puissance de calcul : 10 000 fois supérieure au da Vinci Xi
- Retour de force : Intégration de la sensation tactile
- Vision améliorée : Imagerie 3D 4K avec filtrage numérique
- Instruments intelligents : Capteurs intégrés, durée de vie étendue
- Interface intuitive : Commandes gestuelles, reconnaissance vocale
- Connectivité : Intégration cloud, télémédecine, IA embarquée
Impact sur la classification réglementaire :
Classification du da Vinci 5 :
- Classe : IIb (dispositif actif thérapeutique)
- Règle appliquée : Règle 9 (administration énergie de manière potentiellement dangereuse)
- Composants : Système complexe nécessitant évaluation globale
- Organisme notifié : Requis pour certification CE
Innovations spécifiques 2024 :
| Innovation | Description | Avantage clinique | Impact réglementaire |
|---|---|---|---|
| Retour haptique | Sensation tactile pour chirurgien | Précision améliorée, sécurité | Évaluation ergonomique |
| IA intégrée | Assistance geste, détection anomalies | Réduction erreurs, formation | Validation algorithmes |
| Instruments adaptatifs | Ajustement automatique paramètres | Optimisation procédure | Contrôle logiciel |
| Réalité augmentée | Superposition informations | Guidage peropératoire | Validation précision |
Exigences réglementaires spécifiques :
- Évaluation clinique : Démonstration supériorité vs techniques conventionnelles
- Formation utilisateurs : Programmes certifiés, simulation
- Maintenance : Protocoles stricts, pièces détachées
- Cybersécurité : Protection données patient, mise à jour sécurisée
- Interopérabilité : Compatibilité systèmes hospitaliers
5.2 Intelligence artificielle en médecine

L’intelligence artificielle transforme radicalement le paysage des dispositifs médicaux, avec des applications croissantes dans le diagnostic, la thérapie et la surveillance des patients.
Applications de l’IA médicale en 2024 :
Diagnostic par imagerie :
- Radiologie : Détection cancer, fractures, pathologies pulmonaires
- Ophtalmologie : Screening rétinopathie diabétique, glaucome
- Dermatologie : Classification lésions cutanées, mélanomes
- Pathologie : Analyse histologique automatisée
Surveillance continue :
- Monitoring patient : Détection précoce détérioration
- Prédiction risques : Sepsis, arrêt cardiaque, chutes
- Personnalisation thérapie : Adaptation posologie, protocoles
Classification réglementaire des logiciels d’IA :
La Règle 11 du MDR établit une classification spécifique pour les logiciels selon leur impact décisionnel :
| Classe | Impact décisionnel | Exemples | Conséquences erreur |
|---|---|---|---|
| Classe I | Information uniquement | Calculateurs, archivage PACS | Aucune ou minime |
| Classe IIa | Information pour diagnostic/thérapie | IA aide au diagnostic | Détérioration non grave |
| Classe IIb | Décision avec impact grave | IA diagnostic automatisé | Intervention chirurgicale |
| Classe III | Décision vitale | IA contrôle thérapie critique | Décès ou détérioration irréversible |
Défis réglementaires de l’IA :
Enjeux spécifiques IA médicale :
- Apprentissage continu : Evolution algorithmes post-commercialisation
- Biais algorithmiques : Représentativité données d’entraînement
- Explicabilité : Transparence processus décisionnel
- Validation clinique : Démonstration performance réelle
- Cybersécurité : Protection modèles propriétaires
Évolutions réglementaires 2024 :
- Guide MDCG 2019-11 : Qualification et classification logiciels
- FDA Guidance : Modifications logiciels prédéterminées (PCCP)
- ISO/IEC 23053 : Framework gouvernance IA
- Règlement IA européen : Applications à haut risque médical
5.3 Bio-impression 3D d’organes et tissus
La bio-impression 3D représente l’une des innovations les plus prometteuses pour répondre à la pénurie d’organes pour transplantation. En 2024, cette technologie connaît des avancées majeures vers la production d’organes fonctionnels.
État de l’art en 2024 :
Technologies de bio-impression :
- Inkjet bioprinting : Impression gouttelettes cellulaires
- Extrusion : Dépôt continu bio-encres
- Lithographie : Polymérisation sélective résines
- Bioprinting assisté par laser : Précision subcellulaire
Réalisations concrètes 2024 :
| Tissu/Organe | Statut développement | Applications | Échéance clinique |
|---|---|---|---|
| Peau | Commercialisation | Greffes brûlures, tests cosmétiques | Disponible |
| Cartilage | Essais cliniques | Reconstruction articulaire | 2025-2026 |
| Cornée | Validation préclinique | Transplantation cornéenne | 2026-2027 |
| Foie (mini-organes) | Recherche avancée | Support thérapeutique | 2028-2030 |
| Rein | Preuve concept | Transplantation | > 2030 |
Classification réglementaire :
Classification organes bio-imprimés :
- Tissus simples (peau) : Classe III (implant biologique)
- Organes complexes : Classe III + procédures spéciales
- Thérapies cellulaires : Médicament de thérapie avancée (MTA)
- Dispositifs + cellules : Produits combinés, double réglementation
Défis réglementaires spécifiques :
- Validation biologique : Preuve fonctionnalité, biocompatibilité long terme
- Standardisation : Critères qualité, reproductibilité production
- Traçabilité cellulaire : Origine cellules, contrôle contamination
- Éthique : Consentement donneurs, utilisation cellules embryonnaires
- Surveillance clinique : Suivi long terme, intégration organisme
5.4 Technologies émergentes
Nanotechnologies médicales :
- Nanoparticules thérapeutiques : Délivrance ciblée médicaments
- Nanocapteurs : Détection précoce biomarqueurs
- Nanomatériaux implantables : Revêtements antibactériens
Thérapies géniques et cellulaires :
- CAR-T cells : Immunothérapies personnalisées
- CRISPR thérapeutique : Édition génique in vivo
- Organoïdes : Modèles tissulaires pour tests
Dispositifs connectés et IoMT :
- Capteurs portables : Monitoring continu glycémie, ECG
- Télémédecine intégrée : Consultation à distance
- Plateformes digitales : Suivi thérapeutique personnalisé
Chapitre 6 : Exigences Réglementaires par Classe
6.1 Synthèse des exigences par classe
| Aspect | Classe I | Classe IIa | Classe IIb | Classe III |
|---|---|---|---|---|
| Organisme notifié | Non requis | Requis | Requis | Requis |
| Évaluation clinique | Littérature | Littérature/Études | Études cliniques | Études cliniques |
| Investigation clinique | Facultative | Selon dispositif | Généralement requise | Obligatoire |
| Surveillance post-commercialisation | Rapport PMS | PSUR (2 ans) | PSUR (1 an) | PSUR (1 an) |
| UDI | Niveau emballage | Niveau dispositif | Niveau dispositif | Niveau dispositif |
6.2 Documentation technique requise
Exigences communes (toutes classes) :
- Description et spécifications techniques
- Conception et fabrication
- Gestion des risques (ISO 14971)
- Vérification et validation
- Étiquetage et notice d’utilisation
Exigences spécifiques classes supérieures :
- Classes IIa/IIb/III : Données cliniques, plan surveillance
- Classe III : Analyse bénéfice-risque approfondie
- Implantables : Données biocompatibilité, durabilité
Chapitre 7 : Perspectives d’Avenir
7.1 Évolution du cadre réglementaire
Adaptations prévues 2025-2030 :
- Règlement IA européen : Impact sur dispositifs médicaux intelligents
- Cybersécurité médicale : Nouvelles exigences sécuritaires
- Durabilité environnementale : Éco-conception, recyclage
- Interopérabilité : Standards communication dispositifs
7.2 Technologies disruptives
Horizon 2030 :
- Médecine quantique : Capteurs ultra-sensibles, imagerie
- Bio-hybrides : Intégration cellules vivantes/dispositifs
- Matériaux intelligents : Auto-réparation, adaptation
- Interfaces cerveau-machine : Contrôle neural direct
7.3 Défis sociétaux
- Accès aux soins : Démocratisation technologies avancées
- Éthique médicale : IA décisionnelle, amélioration humaine
- Formation professionnelle : Adaptation compétences
- Acceptabilité sociale : Confiance public, transparence
Conclusion
Le secteur des dispositifs médicaux traverse une période de transformation majeure avec l’entrée en vigueur du règlement européen MDR 2017/745 et l’émergence de technologies révolutionnaires. Cette évolution s’accompagne de défis considérables mais ouvre également des perspectives exceptionnelles pour améliorer la santé humaine.
La classification basée sur les risques, pierre angulaire de la réglementation, continue d’évoluer pour s’adapter aux innovations technologiques. Les dispositifs médicaux implantables actifs, la robotique chirurgicale, l’intelligence artificielle et la bio-impression 3D redéfinissent les paradigmes thérapeutiques traditionnels.
L’avenir du secteur reposera sur la capacité des acteurs à concilier innovation technologique, sécurité patients et accès aux soins. La collaboration entre fabricants, autorités réglementaires, professionnels de santé et patients sera déterminante pour relever ces défis.
Points clés à retenir :
- Le MDR 2017/745 renforce significativement les exigences de sécurité
- La classification par risques guide les obligations réglementaires
- Les innovations 2024 transforment la pratique médicale
- L’adaptation continue du cadre réglementaire est nécessaire
- La formation des acteurs reste un enjeu majeur
Annexes
Annexe A : Références réglementaires
- Règlement (UE) 2017/745 relatif aux dispositifs médicaux
- Règlement (UE) 2017/746 relatif aux dispositifs médicaux de diagnostic in vitro
- Code de la santé publique français (articles L.5211-1 et suivants)
- Guides MDCG (Medical Device Coordination Group)
Annexe B : Normes harmonisées principales
- ISO 13485 : Systèmes de management de la qualité
- ISO 14971 : Gestion des risques
- IEC 62304 : Logiciels de dispositifs médicaux
- ISO 10993 : Évaluation biologique des dispositifs médicaux
Annexe C : Contacts utiles
- ANSM : https://ansm.sante.fr
- Commission européenne : https://health.ec.europa.eu
- EUDAMED : https://ec.europa.eu/tools/eudamed
Document réalisé en 2024
Ce guide constitue un document informatif et ne se substitue pas aux textes réglementaires officiels
OTOSCOPE WELCH ALLYN MACROVIEW