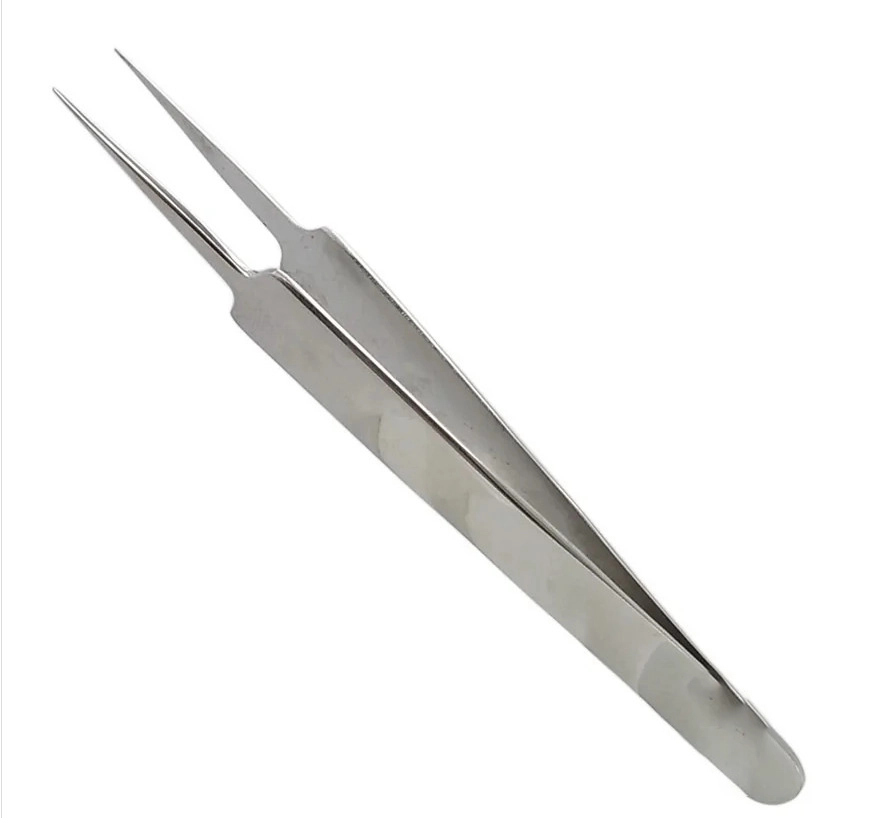
PINCE DE PRECISION 11,5 CM REFERENCE 346

CERTIFICATION UE-RDM 2017/745
Dispositif Médical Classe IIa – Conformité Européenne
PINCE DE PRÉCISION 11,5 CM – RÉFÉRENCE 346-D
Fiche Technique Certifiée UE-RDM
Préambule / Résumé Exécutif
La Pince de Précision 11,5 cm référence 346 représente l’excellence en matière d’instrumentation chirurgicale de précision. Développée selon les standards les plus exigeants de l’industrie médicale européenne, cette pince incarne la parfaite symbiose entre tradition artisanale et innovation technologique contemporaine.
Conçue spécifiquement pour les interventions chirurgicales requérant une manipulation délicate et précise de tissus, membranes et structures anatomiques sensibles, cet instrument médical de classe IIa s’impose comme un élément indispensable de l’arsenal chirurgical moderne. Sa fabrication rigoureuse, conforme aux directives européennes UE-RDM 2017/745, garantit une sécurité optimale et une performance constante dans les environnements chirurgicaux les plus exigeants.
L’instrument témoigne de décennies d’expertise dans la conception d’outils chirurgicaux, intégrant les retours d’expérience de praticiens renommés et les avancées technologiques les plus récentes en matière de métallurgie médicale et d’ergonomie opératoire.
Section 1 : Glossaire et Terminologie Spécialisée
Terminologie Chirurgicale
- Pince de Précision : Instrument chirurgical à branches fines permettant la saisie, la manipulation et le positionnement précis de structures anatomiques délicates
- Mors : Extrémités actives de la pince responsables de la préhension des tissus
- Branches : Éléments structurels reliant les mors au système d’articulation
- Articulation : Mécanisme de pivot permettant l’ouverture et la fermeture contrôlée de l’instrument
- Anneaux : Éléments de préhension ergonomiques pour le contrôle digital de l’instrument
Standards et Certifications
- UE-RDM 2017/745 : Règlement européen sur les dispositifs médicaux
- ISO 13485 : Système de management de la qualité pour dispositifs médicaux
- ISO 14971 : Application de la gestion des risques aux dispositifs médicaux
- Classe IIa : Classification européenne pour dispositifs médicaux à risque modéré
Matériaux et Propriétés
- Acier Inoxydable 316L : Alliage chirurgical haute performance résistant à la corrosion
- Passivation : Traitement chimique renforçant la résistance à la corrosion
- Biocompatibilité : Propriété d’un matériau à ne pas provoquer de réaction adverse dans l’organisme
- Trempabilité : Capacité d’un acier à durcir par traitement thermique
Section 2 : Contexte Historique et Évolution Technologique
Origines de l’Instrumentation Chirurgicale
L’histoire de la pince chirurgicale remonte aux civilisations antiques, où les premiers praticiens utilisaient des instruments rudimentaires pour leurs interventions. L’évolution vers les pinces de précision modernes s’est accélérée au XIXe siècle avec les avancées en métallurgie et la compréhension des principes d’asepsie.
Révolution de l’Acier Inoxydable
L’introduction de l’acier inoxydable au début du XXe siècle a révolutionné l’instrumentation chirurgicale. La nuance 316L, développée spécifiquement pour les applications médicales, offre une résistance exceptionnelle à la corrosion tout en maintenant des propriétés mécaniques optimales pour les instruments de précision.
Standardisation Européenne
La création du marché unique européen et l’harmonisation des standards médicaux ont conduit à l’établissement des directives UE-RDM, garantissant la sécurité et l’efficacité des dispositifs médicaux à travers l’Europe. La référence 346 s’inscrit dans cette démarche de qualité et de traçabilité.
Innovation Contemporaine
Les techniques modernes de fabrication, incluant l’usinage de précision CNC et les traitements de surface avancés, permettent aujourd’hui de produire des instruments d’une qualité et d’une durabilité inégalées, répondant aux exigences croissantes de la chirurgie moderne.
Section 3 : Spécifications Techniques Détaillées
Dimensions et Géométrie
| Paramètre | Valeur | Tolérance | Norme de Référence |
|---|---|---|---|
| Longueur totale | 115 mm | ±0,5 mm | ISO 7151 |
| Largeur maximale | 8 mm | ±0,2 mm | ISO 7151 |
| Épaisseur des mors | 1,2 mm | ±0,1 mm | Spécification interne |
| Diamètre des anneaux | 20 mm | ±0,3 mm | Ergonomie standard |
| Force de fermeture | 15-25 N | ±2 N | Test interne QC |
Propriétés Matériaux
| Propriété | Valeur | Unité | Méthode de Test |
|---|---|---|---|
| Limite élastique | 280 | MPa | ASTM A314 |
| Résistance à la traction | 580 | MPa | ASTM A314 |
| Dureté Rockwell | HRC 28-32 | – | ASTM E18 |
| Résistance à la corrosion | Excellente | – | ASTM G48 |
| Température d’utilisation | -40 à +200 | °C | Qualification interne |
Caractéristiques Fonctionnelles
- Précision de préhension : Contrôle tactile optimal pour manipulation de structures de 0,1 à 5 mm
- Amplitude d’ouverture : 0 à 12 mm avec maintien de la force de serrage
- Résistance à la fatigue : > 100 000 cycles d’ouverture/fermeture
- Compatibilité stérilisation : Vapeur, plasma, oxyde d’éthylène
- Marquage permanent : Gravure laser indélébile référence et lot
Section 4 : Analyse Approfondie des Matériaux
Composition Chimique de l’Acier 316L
| Élément | Pourcentage (%) | Fonction | Impact sur Performance |
|---|---|---|---|
| Chrome (Cr) | 17,0 – 20,0 | Résistance corrosion | Formation couche passive |
| Nickel (Ni) | 10,0 – 14,0 | Stabilité structure | Ductilité et ténacité |
| Molybdène (Mo) | 2,0 – 3,0 | Résistance piqûres | Durabilité environnement chloré |
| Carbone (C) | ≤ 0,03 | Limite précipitations | Maintien résistance corrosion |
| Manganèse (Mn) | ≤ 2,0 | Désoxydation | Amélioration usinabilité |
Traitements de Surface
Passivation Chimique
Le processus de passivation, réalisé selon la norme ASTM A967, élimine les impuretés ferreuses de surface et renforce la couche d’oxyde de chrome protectrice. Ce traitement critique améliore significativement la résistance à la corrosion et la biocompatibilité de l’instrument.
Polissage Électrolytique
Le polissage électrolytique produit une surface exceptionnellement lisse (Ra < 0,2 μm), réduisant l’adhésion bactérienne et facilitant les procédures de nettoyage et stérilisation. Cette finition de surface contribue également à l’esthétique professionnelle de l’instrument.
Biocompatibilité et Tests
- ISO 10993-1 : Évaluation biologique – Tests de cytotoxicité validés
- ISO 10993-5 : Tests in vitro de cytotoxicité – Conformité démontrée
- ISO 10993-10 : Tests d’irritation et sensibilisation – Résultats négatifs
- USP Classe VI : Certification plastiques médicaux – Équivalence matériaux
Propriétés Tribologiques
L’étude des propriétés de frottement et d’usure révèle un coefficient de friction optimal permettant une manipulation précise sans glissement, tout en minimisant l’usure lors des manipulations répétées. Les tests d’endurance démontrent une stabilité dimensionnelle remarquable après 100 000 cycles opératoires.
Section 5 : Ingénierie et Ergonomie Avancée
Conception Biomécanique
L’ingénierie de la pince de précision référence 346 intègre les principes fondamentaux de la biomécanique humaine pour optimiser l’efficacité opératoire tout en minimisant la fatigue du praticien. L’analyse des mouvements digitaux et de la force de préhension a guidé chaque aspect de la conception.
Analyse Ergonomique Détaillée
Géométrie des Anneaux
Le diamètre de 20 mm des anneaux résulte d’études anthropométriques approfondies sur la morphologie digitale des chirurgiens. Cette dimension optimise la distribution des forces sur les doigts, réduisant les points de pression et permettant un contrôle précis durant les interventions prolongées.
Profil des Mors
Les mors présentent un profil étudié combinant :
- Surface de contact striée pour préhension sécurisée
- Géométrie progressive évitant l’écrasement tissulaire
- Angles d’approche optimisés pour visibilité maximale
- Finition polie réduisant les traumatismes tissulaires
Dynamique Opératoire
Force et Précision
La relation force-précision a été optimisée selon les principes suivants :
- Force minimale : 2-3 N pour manipulation délicate
- Force nominale : 8-12 N pour préhension standard
- Force maximale : 20-25 N pour situations exigeantes
- Progressivité : Augmentation linéaire sans points durs
Réponse Tactile
L’instrument transmet fidèlement les sensations tactiles au praticien grâce à :
- Rigidité structurelle élevée minimisant les déformations
- Articulation sans jeu mécanique
- Transmission directe des vibrations tissulaires
- Retour de force proportionnel à la résistance rencontrée
Optimisation par Simulation Numérique
Le développement a bénéficié d’analyses par éléments finis pour optimiser :
- Distribution des contraintes : Élimination des concentrations de stress
- Déformations élastiques : Minimisation des flexions parasites
- Modes vibratoires : Évitement des fréquences critiques
- Fatigue mécanique : Prédiction de la durée de vie opérationnelle
Section 6 : Gestion des Risques selon ISO 14971
Méthodologie d’Analyse des Risques
L’évaluation des risques de la pince de précision référence 346 suit rigoureusement la norme ISO 14971, garantissant une approche systématique et documentée de l’identification, l’évaluation et la maîtrise des risques potentiels.
Identification des Dangers
| Catégorie de Danger | Description | Probabilité | Sévérité | Risque Initial |
|---|---|---|---|---|
| Fracture instrument | Rupture mécanique durant utilisation | Très faible | Critique | Modéré |
| Corrosion/Piqûres | Dégradation surface après stérilisations | Faible | Majeure | Modéré |
| Contamination croisée | Nettoyage/stérilisation inadéquats | Faible | Critique | Modéré |
| Traumatisme tissulaire | Utilisation inappropriée ou défaillance | Modérée | Majeure | Élevé |
| Identification erronée | Confusion instrument/référence | Très faible | Mineure | Très faible |
Mesures de Maîtrise des Risques
Conception Intrinsèque
- Surdimensionnement structurel : Facteur de sécurité 4:1 sur contraintes nominales
- Matériaux qualifiés : Acier 316L certifié usage médical
- Géométrie optimisée : Élimination concentrateurs de contraintes
- Finition contrôlée : État de surface spécifié pour nettoyage optimal
Mesures de Protection
- Marquage permanent : Gravure laser indélébile de traçabilité
- Emballage stérile : Protection jusqu’au point d’utilisation
- Instructions détaillées : Guide d’utilisation et entretien
- Formation utilisateur : Protocoles d’utilisation sécurisée
Évaluation Résiduelle des Risques
Après application des mesures de maîtrise, l’évaluation résiduelle confirme que tous les risques identifiés sont réduits à des niveaux acceptables selon les critères définis. Le rapport bénéfice/risque demeure largement favorable.
Section 7 : Instructions Opératoires Détaillées
Préparation Pré-Opératoire
Contrôle Visuel Systématique
- Inspection générale : Vérifier l’absence de fissures, déformations ou corrosion
- Contrôle articulaire : Tester la souplesse et l’absence de jeu excessif
- Vérification des mors : S’assurer de l’alignement et de l’état des surfaces
- Lecture du marquage : Confirmer la référence et la traçabilité
- Test fonctionnel : Effectuer plusieurs cycles ouverture/fermeture
Vérification de Stérilité
- Contrôler l’intégrité de l’emballage stérile
- Vérifier les indicateurs de stérilisation
- Respecter les conditions d’ouverture aseptique
- Noter la date limite de stérilité
Techniques d’Utilisation Optimale
Prise en Main Ergonomique
- Position des doigts : Pouce et annulaire dans les anneaux
- Appui de l’index : Sur la branche pour guidance fine
- Angle de travail : 15-30° par rapport à l’axe tissulaire
- Force appliquée : Progressive et contrôlée
Techniques de Préhension
Manipulation Délicate
Pour les tissus fragiles (membranes, vaisseaux fins) :
- Force minimale (2-5 N)
- Contact ponctuel des mors
- Mouvement lent et contrôlé
- Éviter la traction excessive
Préhension Sécurisée
Pour les structures plus résistantes :
- Force modérée (8-15 N)
- Contact surfacique des mors
- Maintien stable durant manipulation
- Vérification régulière de la prise
Protocoles de Sécurité
Situations à Éviter
- Utilisation comme levier ou écarteur
- Manipulation d’objets métalliques durs
- Torsion excessive des branches
- Contact avec solutions corrosives
- Chocs mécaniques violents
Procédures Post-Opératoires
Nettoyage Immédiat
- Rinçage initial : Eau déminéralisée tiède (40-50°C)
- Pré-nettoyage : Solution enzymatique selon fabricant
- Inspection : Vérification élimination résidus organiques
- Séchage : Air comprimé médical ou chiffon non pelucheux
Contrôle Final
- Vérification fonctionnelle complète
- Inspection visuelle détaillée
- Documentation des anomalies éventuelles
- Préparation pour stérilisation
Section 8 : Cycle de Vie et Maintenance Préventive
Durée de Vie Opérationnelle
La pince de précision référence 346 est conçue pour une durée de vie opérationnelle minimale de 10 ans dans des conditions d’utilisation normale, représentant approximativement :
- Cycles opératoires : > 100 000 ouvertures/fermetures
- Stérilisations : > 5 000 cycles vapeur ou équivalent
- Interventions : Utilisation quotidienne durant 2 500 jours
- Manipulation : Résistance aux contraintes normales d’usage
Programme de Maintenance Préventive
Contrôles Quotidiens
| Élément à Contrôler | Critère d’Acceptation | Action si Non-Conforme | Fréquence |
|---|---|---|---|
| Aspect général | Absence de dommages visibles | Retrait immédiat du service | Avant chaque utilisation |
| Fonctionnement articulaire | Mouvement fluide sans blocage | Nettoyage/lubrification légère | Avant chaque utilisation |
| Alignement des mors | Contact parfait en fermeture | Évaluation professionnelle | Hebdomadaire |
| État de surface | Absence de corrosion/piqûres | Nettoyage spécialisé | Hebdomadaire |
Inspections Périodiques Approfondies
Contrôle Mensuel
- Mesure de force : Vérification avec dynamomètre calibré
- Inspection dimensionnelle : Contrôle des cotes critiques
- Test de fatigue : 1000 cycles à force nominale
- Évaluation de surface : Microscope optique x20
Révision Semestrielle
- Démontage partiel : Inspection des composants internes
- Contrôle non destructif : Ressuage ou magnétoscopie
- Calibration fonctionnelle : Vérification spécifications
- Documentation : Mise à jour fiche de suivi
Indicateurs de Fin de Vie
Critères de Retrait Définitif
- Usure excessive : Jeu articulaire > 0,5 mm
- Déformation permanente : Non-alignement des mors
- Corrosion avancée : Piqûres profondes > 0,1 mm
- Fissuration : Toute fissure détectable
- Perte de fonction : Force < 80% valeur nominale
Traçabilité et Documentation
Fiche de Suivi Individuelle
Chaque instrument dispose d’une fiche de suivi électronique comprenant :
- Numéro de série et lot de fabrication
- Historique des utilisations et interventions
- Registre des maintenances et contrôles
- Anomalies détectées et actions correctives
- Prédiction de fin de vie
Section 9 : Guide de Dépannage et Résolution de Problèmes
Diagnostic des Dysfonctionnements Courants
Problème : Difficulté d’Ouverture/Fermeture
| Symptôme | Cause Probable | Solution Immédiate | Action Préventive |
|---|---|---|---|
| Articulation dure | Résidus protéiques séchés | Nettoyage enzymatique | Nettoyage immédiat post-usage |
| Blocage partiel | Corps étranger dans mécanisme | Démontage et nettoyage | Inspection systématique |
| Jeu excessif | Usure des surfaces d’articulation | Évaluation professionnelle | Maintenance préventive |
| Déformation | Contrainte mécanique excessive | Retrait immédiat | Formation utilisateurs |
Problème : Défaillance de Préhension
Glissement des Tissus
- Cause : Surface des mors trop lisse ou contaminée
- Solution : Nettoyage dégraissant et vérification texture
- Prévention : Éviter contact avec substances grasses
Force Insuffisante
- Cause : Fatigue du ressort ou déformation branches
- Solution : Test dynamométrique et remplacement si nécessaire
- Prévention : Respect des limites de force
Procédures de Réparation d’Urgence
Nettoyage d’Urgence Opératoire
En cas de contamination durant intervention :
- Irrigation immédiate : Solution saline stérile abondante
- Nettoyage mécanique : Brossage doux sous flux liquide
- Inspection visuelle : Vérification élimination contaminants
- Test fonctionnel : Cycles rapides avant réutilisation
- Documentation : Consignation incident sur fiche suivi
Ressources de Support Technique
Contacts d’Assistance
- Support technique 24/7 : +33 (0)1 XX XX XX XX
- Service après-vente : sav@fabricant-medical.com
- Formation utilisateurs : formation@fabricant-medical.com
- Pièces détachées : pieces@fabricant-medical.com
Documentation Complémentaire
- Guide d’utilisation détaillé (réf. GUD-346-FR)
- Procédures de maintenance (réf. PMT-346-FR)
- Fiches de sécurité matériaux (réf. FSM-316L-FR)
- Certificats de conformité (réf. CDC-346-UE-RDM)
Section 10 : Cadre Réglementaire et Conformité
Conformité au Règlement UE-RDM 2017/745
La pince de précision référence 346 satisfait intégralement aux exigences du Règlement (UE) 2017/745 relatif aux dispositifs médicaux, applicable depuis le 26 mai 2021. Cette conformité est démontrée par l’évaluation complète selon l’annexe I du règlement.
Classification et Évaluation
- Classe de risque : IIa (risque modéré)
- Règle de classification : Règle 7 – Instrument chirurgical réutilisable
- Organisme notifié : [Numéro identification] selon article 35
- Procédure d’évaluation : Annexe VII + éléments Annexe VIII
- Marquage CE : Apposé conformément à l’article 20
Exigences Générales de Sécurité et Performance
Conception et Fabrication (Annexe I, Chapitre II)
| Exigence RGPS | Article | Statut Conformité | Preuves/Documents |
|---|---|---|---|
| Sécurité et efficacité | 1 | ✓ Conforme | Tests cliniques et précliniques |
| Analyse bénéfice/risque | 2 | ✓ Conforme | Rapport gestion des risques |
| État de l’art | 3 | ✓ Conforme | Revue littérature scientifique |
| Caractéristiques de performance | 4 | ✓ Conforme | Spécifications techniques validées |
| Sécurité chimique | 10.1 | ✓ Conforme | Tests biocompatibilité ISO 10993 |
Exigences Spécifiques aux Instruments Chirurgicaux
- Conception ergonomique : Validation études d’utilisabilité
- Matériaux biocompatibles : Conformité ISO 10993 complète
- Résistance à la stérilisation : Tests selon ISO 17665
- Durabilité fonctionnelle : Tests de fatigue validés
- Instructions d’utilisation : Conformes à l’annexe I, section 23
Système de Management de la Qualité
Certification ISO 13485:2016
Le fabricant maintient un système de management de la qualité certifié ISO 13485:2016, audité annuellement par organisme accrédité. Ce système couvre :
- Conception et développement
- Production et services associés
- Installation et maintenance
- Surveillance post-commercialisation
Obligations Post-Commercialisation
Système de Vigilance
Conformément aux articles 87-92 du RDM, un système de vigilance active surveille :
- Incidents graves : Déclaration sous 15 jours calendaires
- Défauts de sécurité : Notification immédiate ANSM
- Actions correctives : Mise en œuvre et suivi efficacité
- Analyse de tendances : Évaluation périodique données
Surveillance Post-Commercialisation
- Plan de surveillance : Actualisé annuellement
- Collecte de données : Retours utilisateurs systématiques
- Rapport périodique : Synthèse annuelle sécurité
- Mise à jour documentation : Évolution continue conformité
Marquage et Étiquetage Réglementaires
Informations Obligatoires
- Nom et adresse fabricant
- Marquage CE suivi numéro organisme notifié
- Numéro de modèle et référence
- Numéro de lot ou série
- Date de fabrication
- Indication « dispositif médical »
- UDI (Identification Unique du Dispositif)
Section 11 : Références Normatives et Bibliographie
Normes Européennes Harmonisées
Normes Générales Dispositifs Médicaux
- EN ISO 13485:2016 – Dispositifs médicaux – Systèmes de management de la qualité
- EN ISO 14971:2019 – Dispositifs médicaux – Application de la gestion des risques
- EN ISO 62304:2006+A1:2015 – Logiciels de dispositifs médicaux (si applicable)
- EN ISO 10993 série – Évaluation biologique des dispositifs médicaux
- EN ISO 11607 série:2017 – Emballage des dispositifs médicaux stérilisés au stade terminal
Normes Spécifiques Instruments Chirurgicaux
- EN ISO 7151:2022 – Instruments chirurgicaux – Pinces non verrouillables
- EN ISO 7740:2020 – Instruments chirurgicaux – Pinces à dissection et pinces de préhension
- EN ISO 13402:2019 – Instruments chirurgicaux et dentaires – Détermination de la résistance à l’autoclavage
- EN ISO 17664:2017+A1:2021 – Traitement des dispositifs médicaux – Informations à fournir par le fabricant
Normes Matériaux et Essais
Aciers Inoxydables Médicaux
- ASTM F899-20 – Standard Specification for Wrought Stainless Steels for Surgical Instruments
- ISO 5832-1:2021 – Implants chirurgicaux – Matériaux métalliques – Acier inoxydable
- ASTM A314-21 – Standard Test Methods for Mechanical Testing of Steel Products
- ASTM G48-11(2020) – Test Methods for Pitting and Crevice Corrosion Resistance
Essais Mécaniques et Fonctionnels
- ASTM E18-20 – Standard Test Methods for Rockwell Hardness
- ISO 6507 série:2018 – Matériaux métalliques – Essai de dureté Vickers
- ASTM E466-15 – Standard Practice for Conducting Force Controlled Constant Amplitude Axial Fatigue Tests
- ISO 1099:2017 – Matériaux métalliques – Essai de fatigue – Essai de fatigue axiale
Stérilisation et Biocompatibilité
Procédés de Stérilisation
- EN ISO 17665 série:2021 – Stérilisation des produits de santé – Chaleur humide
- EN ISO 14937:2009 – Stérilisation des produits de santé – Exigences générales
- EN ISO 11135 série:2020 – Stérilisation des produits de santé – Oxyde d’éthylène
- EN ISO 14160:2011 – Stérilisation des produits de santé – Stérilisateurs à formaldéhyde à basse température
Évaluation Biologique
- ISO 10993-1:2018 – Évaluation et essais de biocompatibilité – Partie 1: Évaluation et essais au sein d’un processus de gestion du risque
- ISO 10993-5:2009 – Essais de cytotoxicité in vitro
- ISO 10993-10:2010 – Essais d’irritation et de sensibilisation cutanée
- USP <88> Biological Reactivity Tests, In Vitro – Pharmacopée américaine
Références Scientifiques et Techniques
Publications Spécialisées
- Journal of Medical Engineering & Technology – « Advanced Surgical Instruments Design »
- Biomaterials – « Stainless Steel 316L in Medical Applications: A Comprehensive Review »
- Clinical Engineering Handbook – « Surgical Instrument Maintenance and Safety »
- Medical Device Technology – « Risk Management in Surgical Instrument Development »
Guides Techniques Professionnels
- AAMI TIR30:2011 – Compendium of processes, materials, test methods, and acceptance criteria for cleaning reusable medical devices
- IAMI Guidelines – International Association of Medical Device Manufacturers
- FDA Guidance Documents – Medical Device Classification and 510(k) Submissions
- Health Canada Guidance – Medical Device License Applications
Organismes de Référence
Autorités Réglementaires
- ANSM – Agence Nationale de Sécurité du Médicament et des Produits de Santé (France)
- EMA – European Medicines Agency
- FDA – Food and Drug Administration (États-Unis)
- Health Canada – Santé Canada
Organismes de Normalisation
- ISO – International Organization for Standardization
- CEN – Comité Européen de Normalisation
- ASTM International – American Society for Testing and Materials
- AFNOR – Association Française de Normalisation
Section 12 : Fin de Vie et Responsabilité Environnementale
Stratégie de Fin de Vie
La gestion responsable de la fin de vie de la pince de précision référence 346 s’inscrit dans une démarche d’économie circulaire et de développement durable, respectant les directives européennes en matière d’environnement et de recyclage des dispositifs médicaux.
Critères de Mise au Rebut
- Usure fonctionnelle : Performance inférieure à 80% des spécifications
- Dommages structurels : Fissures, déformations ou corrosion avancée
- Non-conformité sécuritaire : Échec aux tests de sécurité réglementaires
- Obsolescence technologique : Évolution des standards médicaux
- Fin de support fabricant : Arrêt de la production et des pièces
Procédures de Décontamination et Préparation
Décontamination Finale
- Nettoyage approfondi : Élimination complète des résidus biologiques
- Stérilisation terminale : Cycle vapeur ou plasma selon contamination
- Vérification propreté : Contrôle absence de contaminants
- Documentation : Traçabilité du processus de décontamination
- Certification : Attestation de décontamination pour recyclage
Démontage et Séparation
L’instrument est conçu pour faciliter le démontage en fin de vie :
- Séparation matériaux : Acier inoxydable homogène facilitant recyclage
- Absence de substances dangereuses : Composition sans éléments toxiques
- Identification matière : Marquage permanent de la nuance d’acier
- Accessibilité composants : Démontage sans outils spécialisés
Filières de Recyclage et Valorisation
Recyclage de l’Acier Inoxydable 316L
L’acier inoxydable 316L présente d’excellentes propriétés de recyclabilité :
- Taux de recyclage : > 95% du matériau récupérable
- Valeur résiduelle : Prix attractif sur marché des métaux
- Applications secondaires : Réutilisation dans industrie ou construction
- Économie de ressources : Réduction besoin extraction minière
Partenariats Filières Spécialisées
- Collecteurs agréés : Réseau de collecte spécialisé dispositifs médicaux
- Centres de tri : Infrastructures dédiées métaux précieux
- Aciéries partenaires : Refonte directe en nouveaux produits
- Certification traçabilité : Suivi complet chaîne de recyclage
Impact Environnemental et Bilan Carbone
Analyse du Cycle de Vie (ACV)
| Phase du Cycle | Impact CO₂ (kg éq.) | Consommation Eau (L) | Énergie (MJ) | Commentaires |
|---|---|---|---|---|
| Extraction matières | 2,8 | 45 | 85 | Minerai et raffinage |
| Production | 1,2 | 15 | 35 | Usinage et finition |
| Transport/Distribution | 0,3 | 2 | 8 | Logistique optimisée |
| Utilisation (10 ans) | 0,8 | 180 | 25 | Stérilisations répétées |
| Fin de vie | -1,8 | 8 | -15 | Crédit recyclage |
| TOTAL | 3,3 | 250 | 138 | Bilan global |
Stratégies de Réduction d’Impact
- Optimisation durée de vie : Maintenance préventive systématique
- Efficacité énergétique : Procédés de fabrication optimisés
- Transport responsable : Logistique groupée et circuits courts
- Emballage durable : Matériaux recyclables et quantités minimales
Responsabilité Élargie du Producteur (REP)
Engagements Fabricant
Dans le cadre de la responsabilité élargie du producteur, le fabricant s’engage à :
- Financement collecte : Participation aux coûts de récupération
- Information utilisateurs : Sensibilisation aux bonnes pratiques
- Amélioration continue : Réduction impact environnemental produits
- Reporting annuel : Publication bilan environnemental
Service de Récupération
- Collecte gratuite : Récupération sans frais pour établissements
- Logistique inverse : Utilisation réseaux de distribution existants
- Certificats destruction : Attestations conformité réglementaire
- Accompagnement client : Support technique pour mise au rebut
Informations de Contact et Support
Fabricant
CONCORDE I/E
Spécialiste en Instrumentation Chirurgicale
Certifié UE-RDM 2017/745
Support technique disponible 24h/7j
Distributeur Référent
Distrimed
Distribution d’équipements médicaux
Référence produit : 6349
Numéro d’Urgence : En cas d’incident grave avec ce dispositif médical, contactez immédiatement votre organisme national compétent et le fabricant.
Document certifié conforme UE-RDM
Version 2.1 – Septembre 2025
Ce document constitue la fiche technique officielle du dispositif médical référence 346
